Questão 01 sobre Eletrólise e Leis de Faraday: (Unimontes-MG–2009) Os metais alcalinoterrosos são obtidos através da eletrólise ígnea de seus compostos. Assim, o cálcio pode ser obtido a partir do fluoreto de cálcio (CaF2), segundo a equação:
Ca2+ + 2F– → Ca + F2
Sabendo-se que a diferença de potencial dessa reação é igual a –5,63 V, pode-se afirmar que:
A) a eletrólise ocorre ao se usar uma bateria com voltagem superior a 5,63 V.
B) os íons fluoreto sofrem redução no cátodo da célula, para formar o gás flúor.
C) a molécula de água compete com os íons de cálcio no cátodo da célula.
D) o cálcio metálico se forma no ânodo, depositando-se no fundo da célula.
Questão 02. (UFU-MG–2009) A eletrólise é um processo que separa, na cela eletrolítica, os elementos químicos de uma substância, através do uso da eletricidade. Esse processo é um fenômeno físico-químico de reação de oxirredução não espontânea. Uma importante aplicação industrial da eletrólise é a obtenção de sódio metálico, com eletrodos inertes, a partir de cloreto de sódio fundido.
A respeito desse processo industrial, é CORRETO afirmar que, além da obtenção do sódio metálico, também se observa a formação:
A) de hidróxido de sódio fundido, basificando o meio, e de moléculas de gás cloro e de gás hidrogênio, respectivamente, no ânodo e no cátodo dacelaeletrolítica.
B) tanto de moléculas de gás cloro como de gás hidrogênio, respectivamente, no ânodo e no cátodo da cela eletrolítica.
C) de moléculas de gás cloro no ânodo da cela eletrolítica.
D) de moléculas de gás hidrogênio no cátodo da cela eletrolítica.
Questão 03 sobre Eletrólise e Leis de Faraday: (Enem–2009) Para que apresente condutividade elétrica adequada a muitas aplicações, o cobre bruto obtido por métodos térmicos é purificado eletroliticamente. Nesse processo, o cobre bruto impuro constitui o ânodo da célula, que está imerso em uma solução de CuSO4. À medida que o cobre impuro é oxidado no ânodo, íons Cu2+ da solução são depositados na forma pura no cátodo. Quanto às impurezas metálicas, algumas são oxidadas, passando à solução, enquanto outras simplesmente se desprendem do ânodo e se sedimentam abaixo dele. As impurezas sedimentadas são posteriormente processadas, e sua comercialização gera receita que ajuda a cobrir os custos do processo. A série eletroquímica a seguir lista o cobre e alguns metais presentes como impurezas no cobre bruto de acordo com suas forças redutoras relativas.
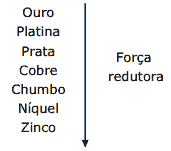
Entre as impurezas metálicas que constam na série apresentada, as que se sedimentam abaixo do ânodo de cobre são:
A) Au, Pt, Ag, Zn, Ni e Pb.
B) Au, Pt e Ag.
C) Zn, Ni e Pb.
D) Au e Zn.
E) Ag e Pb.
Questão 04. (Enem–2010) A eletrólise é muito empregada na indústria com o objetivo de reaproveitar parte dos metais sucateados. O cobre, por exemplo, é um dos metais com maior rendimento no processo de eletrólise, com uma recuperação de aproximadamente 99,9%. Por ser um metal de alto valor comercial e de múltiplas aplicações, sua recuperação torna-se viável economicamente. Suponha que, em um processo de recuperação de cobre puro, tenha-se eletrolisado uma solução de sulfato de cobre (II) (CuSO4) durante 3 h, empregando-se uma corrente elétrica de intensidade igual a 10 A. A massa de cobre puro recuperada é de aproximadamente Dados: Constante de Faraday F = 96 500 C/mol; Massa molar em g/mol: Cu = 63,5.
A) 0,02 g.
B) 0,04 g.
C) 2,40 g
D) 35,5 g.
E) 71,0 g.
Questão 05 sobre Eletrólise e Leis de Faraday: UERJ) Muitas latas utilizadas em embalagens de alimentos industrializados são formadas a partir de uma folha de ferro, revestida internamente por uma camada de estanho metálico. A aplicação dessa camada sobre o ferro se dá por meio de um processo de eletrodeposição, representado pela seguinte reação:
Sn2+ (aq) + 2e– → Sn(s)
Admitindo que em uma lata exista, em média, 1,19×10-3 g de estanho e que 1 F = 96 500 C, CALCULE o tempo necessário para a eletrodeposição de uma lata, mediante o emprego de uma corrente elétrica com intensidade de 0,100 A.
Questão 06. (UFMG) Em relação a uma corrente elétrica contínua conduzida por uma solução, durante uma eletrólise, qual é a afirmação ERRADA?
A) O número de elétrons que entram na solução por um eletrodo é igual ao número de elétrons que deixam a solução pelo outro eletrodo.
B) O movimento de íons de eletrólito é o responsável pela condução da corrente elétrica através da solução.
C) Durante a eletrólise, a solução do eletrólito permanece eletricamente neutra.
D) No eletrodo positivo, ocorre reação de oxidação e no eletrodo negativo ocorre reação de redução.
E) O número de cátions que migram para o cátodo é sempre igual ao número de ânions que migram para o ânodo.
Questão 07 sobre Eletrólise e Leis de Faraday: (FUVEST-SP) A eletrólise de cloreto de sódio fundido produz sódio metálico e gás cloro.
Nesse processo, cada íon:
A) sódio recebe 2 elétrons.
B) cloreto recebe 1 elétron.
C) sódio recebe 1 elétron.
D) cloreto perde 2 elétrons.
E) sódio perde 1 elétron.
Questão 08. (UFMG) Em relação à eletrólise de uma solução aquosa de CuCℓ 2, qual a afirmativa ERRADA?
A) Há deposição de cobre metálico no eletrodo negativo.
B) A reação que se passa na eletrólise pode ser representada pela equação Cu + Cℓ2 → Cu2+ + 2Cℓ–.
C) Há formação de cloro gasoso no eletrodo positivo.
D) Os íons Cℓ– são oxidados.
E) Os íons Cu2+ são reduzidos.
Questão 09. (FUVEST-SP) Uma solução aquosa de iodeto de potássio (KI) foi eletrolisada usando-se a aparelhagem esquematizada na figura.
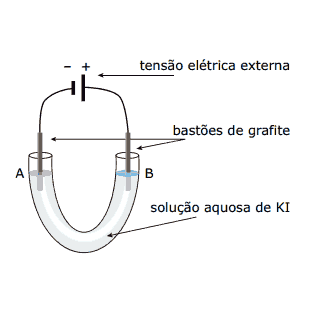
Após algum tempo de eletrólise, adicionaram-se algumas gotas de solução de fenolftaleína na região do eletrodo A e algumas gotas de solução de amido na região do eletrodo B. Verificou-se o aparecimento da cor rosa na região de A e da cor azul (formação de iodo) na região de B.
Nessa eletrólise:
I. no polo negativo, ocorre redução da água com formação de OH– e de H2.
II. no polo positivo, o iodeto ganha elétrons e forma iodo.
III. a grafite atua como condutora de elétrons.
Dessas afirmações, apenas a:
A) I é correta.
B) II é correta.
C) III é correta.
D) I e a III são corretas.
E) II e a III são corretas.
Questão 10 sobre Eletrólise e Leis de Faraday: (UDESC-SC–2006) Qual o volume de gás flúor que pode ser produzido quando uma corrente de 0,5 A é passada por fluoreto de potássio fundido durante 8 horas?
Considere que o gás produzido se encontra a 273 K e 1,0 atm de pressão.
A) 1,68 L
B) 0,93 mL
C) 6,7 L
D) 0,84 L
E) 3,3 L
🔵 >>> Confira a lista completa com todos os exercícios de Química.
Gabarito com as respostas dos exercícios de Química sobre Eletrólise e Leis de Faraday:
01. A;
02. C;
03. B;
04. D;
05. 19,3 s;
06. E;
07. C;
08. B;
09. D;
10. A;
Doutorando em Genética e Biologia Molecular – UESC-BA
Mestre em Genética e Biologia Molecular – UESC-BA
Pós-Graduado em Metodologia do Ensino de Biologia e Química – FAEL
Licenciado em Ciências Biologias – IFMT/Campus Juína
