Questão 01 sobre Equilíbrio de Solubilidade: (PUC-SP) Uma solução saturada de base, representada por X(OH)2, cuja reação de equilíbrio é:
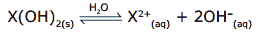
tem um pH = 10 a 25 ºC. O produto de solubilidade (Kps) do X(OH)2 é:
A) 5×10-13.
B) 2×10-13.
C) 6×10-12.
D) 1×10-12.
E) 3×10-10.
Questão 02. (UFJF-MG) A solubilidade de CaCO3 em água, a 20 ºC, é igual a 13 mg.L-1. Qual o valor da constante de solubilidade (Kps) nessa temperatura, sabendo-se que a mesma é dada em mol2.L-2?
Dado: Massa molar do CaCO3 = 100 g.mol-1
A) 1,69×10-4
B) 1,69×10-8
C) 1,30×10-2
D) 1,30×10-8
E) 1,69×10-2
Questão 03 sobre Equilíbrio de Solubilidade: (UERJ) No início do ano de 2003, verificou-se que o principal componente de um medicamento usado como contraste radiológico – o sulfato de bário – estava contaminado com carbonato de bário, mais solúvel em água do que o sulfato.
Admita que foram preparadas duas soluções aquosas saturadas: a solução 1, apenas com sulfato de bário puro, e a solução 2, apenas com carbonato de bário puro.
Designando o produto de solubilidade do sulfato de bário por Kps1 e o do carbonato de bário por Kps2, a razão entre a concentração em mol.L-1 do cátion bário na solução 1 e na solução 2 é expressa por:
A) (Kps1/Kps2)-2.
B) Kps1/Kps2.
C) (Kps1/Kps2)1/2.
D) (Kps1/Kps2)2.
Questão 04. (UFU-MG–2006) O sulfato de bário é pouco solúvel em água (Kps = 1,3×10-10 a 25 ºC). Embora os íons bário sejam tóxicos (concentração máxima tolerada ≅ 1,0 mg.L-1), esse sal é muito usado como contraste em exames radiológicos administrados via oral ou retal.
Sabendo que um paciente é alérgico ao íon bário e que a dissolução de sulfato de bário é endotérmica, a MELHOR maneira de reduzir a concentração de íons bário em uma suspensão aquosa de uso oral é:
A) adicionar um pouco de sulfato de sódio.
B) aquecer a suspensão e dar ao paciente.
C) adicionar mais sulfato de bário sólido.
D) filtrar os íons antes de dar ao paciente.
Questão 05 sobre Equilíbrio de Solubilidade: (FCMMG–2011) Considere uma solução em que [Pb2+] = 5,6×10-4 mol/L. Sabe-se que a constante do produto de solubilidade para Pbl2(s) é igual a 1,4×10-8.
Considerando-se essas informações, pode-se concluir que a concentração mínima de íons iodeto, em mol/L, que provocará a precipitação de Pbl2(s), na solução acima referida, é:
A) 5,0×10-3 mol/L.
B) 2,5×10-5 mol/L.
C) 2,5×10-3 mol/L.
D) 1,1×10-3 mol/L.
Questão 06. (UNIFESP) Compostos de chumbo podem provocar danos neurológicos gravíssimos em homens e animais. Por essa razão, é necessário um controle rígido sobre os teores de chumbo liberado para o ambiente. Um dos meios de se reduzir a concentração do íon Pb2+ em solução aquosa consiste em precipitá-lo, pela formação de compostos poucos solúveis, antes do descarte final dos efluentes. Suponha que sejam utilizadas soluções de sais de Na+ com os ânions Xn–, listados na tabela a seguir, com concentrações finais de Xn– iguais a 10–2 mol.L–1, como precipitantes.
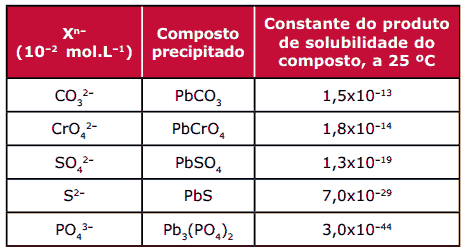
Assinale a alternativa que contém o agente precipitante MAIS eficiente na remoção do Pb2+ do efluente.
A) CO32-
B) CrO42-
C) SO42-
D) S2-
E) PO43–
Questão 07 sobre Equilíbrio de Solubilidade: (PUC Rio) O produto de solubilidade do AgCℓ é 1,8×10–10 a 298 K. Assinale a alternativa que indica a concentração de íons Ag+, que se obtém no equilíbrio, quando se adiciona um excesso de AgCℓ em uma solução 0,1 M de NaCℓ.
A) 3,6×10-10 M
B) 1,8×10-9 M
C) 1,8×10-5 M
D) 10-5 M
E) 10-1 M
Questão 08. (PUC Rio–2010) Considere a reação do nitrato de prata com acetato de sódio que dá origem ao acetato de prata, que é muito pouco solúvel em água, e ao nitrato de sódio, que é totalmente solúvel em água. Essa reação é representada por:
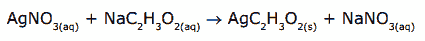
O precipitado de acetato de prata, em meio aquoso, estabelece equilíbrio com as suas espécies iônicas em solução saturada.
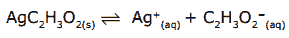
Sendo a solubilidade do acetato de prata, a 25 ºC, igual a 4,36×10-2 mol.L-1, é CORRETO afirmar que, nessa temperatura, o produto de solubilidade do AgC2H3O2 é, aproximadamente, igual a:
A) 1,9×10-3.
B) 2,18×10-2.
C) 4,1×10-3.
D) 6,0×10-2.
E) 8,72×10-3.
Questão 09. (UFOP-MG–2007) O sulfato de bário é usado como contraste para raios X no diagnóstico de doenças no trato digestivo. Embora o bário seja tóxico para o ser humano, o BaSO4 pode ser utilizado para tal fim, uma vez que essa substância é pouco solúvel em água (Kps = 1,0×10-10).
Um radiologista adicionou sulfato de bário sólido à água, a fim de obter uma solução saturada, mas gostaria de reduzir substancialmente a concentração de íons bário antes da ingestão pelo paciente. O que deve fazer o radiologista, considerando que:
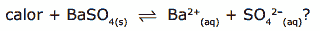
A) Adicionar sulfato de sódio suficiente para que [Na+] = 0,05 mol.L-1.
B) Adicionar ácido sulfúrico até que o pH seja igual a 5.
C) Remover um pouco da solução saturada.
D) Aquecer a mistura.
Questão 10 sobre Equilíbrio de Solubilidade: (UNIFESP–2009) Um composto iônico, a partir da concentração de sua solução aquosa saturada, a 25 ºC, pode ser classificado de acordo com a figura, quanto à solubilidade em água.

Um litro de solução aquosa saturada de PbSO4 (M= 303 g/mol), a 25 ºC, contém 45,5 mg de soluto. O produto de solubilidade do CaCrO4, a 25 ºC, é 6,25×10–4.
Quanto à solubilidade em água, a 25 ºC, os compostos PbSO4 e CaCrO4 podem ser classificados, respectivamente, como:
A) insolúvel e ligeiramente solúvel.
B) insolúvel e solúvel.
C) insolúvel e insolúvel.
D) ligeiramente solúvel e insolúvel.
E) ligeiramente solúvel e solúvel.
Questão 11. (UFRGS) Se o produto de solubilidade do cloreto de césio é Kps, a solubilidade desse sal será igual a:
A) Kps√2.
B) √Kps.
C) Kps2.
D) 2Kps.
E) Kps.
Questão 12. Modelo Enem. Um dos problemas desenvolvidos pelo consumo continuado do cigarro é a formação de uma camada amarelada nos dentes. Além desse problema, a fumaça do cigarro acidifica o meio bucal, promovendo a desmineralização da camada de esmalte que protege a dentição, a qual é constituída, basicamente, do mineral hidroxiapatita, de fórmula Ca5(PO4)3OH. A equação que representão processo de desmineralização é:
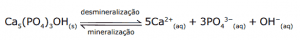
A desmineralização expõe o dente à cárie, pois corrói o esmalte protetor. Uma maneira de se evitar as cáries é escovar constantemente os dentes com cremes dentais que possuam, em sua constituição, flúor. O flúor encontrado nos cremes dentais e nas águas tratadas dos grandes centros urbanos se encontra na forma de íons fluoreto, que, na presença da hidroxiapatita, estabelecem um equilíbrio de troca iônica, formando a fluorapatita.
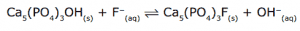
A fluorapatita é mais resistente ao processo de desmineralização, diminuindo a incidência de cárie bucal, pois apresenta:
A) mesmo valor de Kps do que a hidroxiapatita, mas menor solubilidade do que este mineral.
B) maior valor de Kps e menor solubilidade do que a hidroxiapatita.
C) rede cristalina menos estável do que a hidroxiapatita.
D) rede cristalina mais estável do que a hidroxiapatita.
E) menor valor de Kps e menor solubilidade do que a hidroxiapatita.
Questão 13 sobre Equilíbrio de Solubilidade: (FUVEST-SP–2006) Preparam-se duas soluções saturadas, uma de oxalato de prata (Ag2C2O4) e outra de tiocianato de prata (AgSCN). Esses dois sais têm, aproximadamente, o mesmo produto de solubilidade (da ordem de 10-12). Na primeira, a concentração de íons prata é [Ag+]1 e, na segunda, [Ag+]2, as concentrações de oxalato e tiocianato são, respectivamente, [C2O42-] e [SCN–].
Nesse caso, é CORRETO afirmar que:
A) [Ag+]1 = [Ag+]2 e [C2O42-] < [SCN–].
B) [Ag+]1 > [Ag+]2 e [C2O42-] > [SCN–].
C) [Ag+]1 > [Ag+]2 e [C2O42-] = [SCN–].
D) [Ag+]1 < [Ag+]2 e [C2O42-] < [SCN–].
E) [Ag+]1 = [Ag+]2 e [C2O42-] > [SCN–].
🔵 >>> Confira a lista completa com todos os exercícios de Química.
Gabarito com as respostas do simulado com exercícios de química sobre Equilíbrio de Solubilidade:
01. A;
02. B;
03. C;
04. A;
05. A;
06. D;
07. B;
08. A;
09. A;
10. A;
11. B;
12. E;
13. B
Doutorando em Genética e Biologia Molecular – UESC-BA
Mestre em Genética e Biologia Molecular – UESC-BA
Pós-Graduado em Metodologia do Ensino de Biologia e Química – FAEL
Licenciado em Ciências Biologias – IFMT/Campus Juína
