Questão 01 sobre Gráficos Termocinéticos: (UFMG) Observe o diagrama.
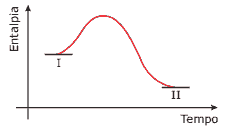
Ele mostra a variação de entalpia no decorrer de uma reação química, à pressão constante, em que as espécies representadas por I se transformam naquelas representadas por II.
Com relação a essa reação, todas as alternativas estão corretas, EXCETO:
A) A conversão de I em II é exotérmica.
B) A conversão de I em II ocorre com diminuição da entalpia do sistema.
C) A energia de ativação de I→II é menor do que a de II→I.
D) A equação termoquímica pode ser escrita I + calor → II.
E) A formação de II é acompanhada por aumento de temperatura da vizinhança.
Questão 02. (UEM-PR) Considerando-se o gráfico a seguir, que representa uma reação genérica na qual podem ser obtidos, simultaneamente, dois produtos diferentes, assinale o que for CORRETO.
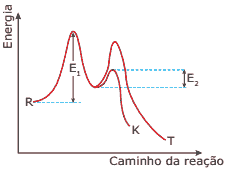
01. Os compostos K e T são obtidos através de uma reação exotérmica.
02. A velocidade de formação do produto T é menor que a do produto K.
04. O produto T é mais estável que o produto K.
08. A energia representada pela letra E1 corresponde à energia de ativação para a formação de um composto intermediário, e a energia representada pela letra E2 corresponde à energia de ativação para a formação do produto K.
16. Se a reação tiver início a partir do mesmo reagente R, é possível supor que o produto K se formará primeiro, mas que o mesmo se converterá, espontaneamente, no produto T.
32. O gráfico evidencia a formação de um intermediário comum.
64. A reação apresentada pela curva do produto T pode ser dita catalisada, enquanto a do produto K é não catalisada.
Soma ( )
Questão 03 sobre Gráficos Termocinéticos: Modelo Enem. A hidrólise do brometo de metila pode ser representada pela equação e pelo gráfico a seguir:
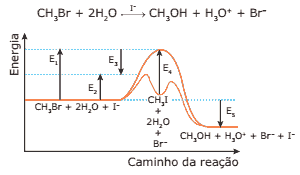
Com relação a essa reação, assinale a alternativa que contém a afirmação INCORRETA.
A) O íon iodeto é catalisador da reação, que se processa com liberação de calor.
B) E4 é a energia de ativação do catalisador, que é o íon iodeto.
C) E3 é o abaixamento de energia de ativação devido ao catalisador.
D) E5 é a variação de entalpia da reação, que é exotérmica.
E) E1 é a energia de ativação sem catalisador e E2 é a energia de ativação com catalisador.
Questão 04. (UFMG–2009) O propeno, CH3—CH=CH2, ao reagir com o brometo de hidrogênio, HBr, produz uma mistura de dois compostos – o brometo de n-propila, CH3—CH2—CH2Br,
e o brometo de isopropila, CH3—CHBr—CH3. As reações responsáveis pela formação desses compostos estão representadas nestas duas equações:
Reação I
CH 3—CH=CH2 + HBr → CH3—CH2—CH2Br brometo de n-propila ∆H = –150 kJ/mol
Reação II
CH3—CH=CH2 + HBr → CH3—CHBr—CH3 brometo de isopropila ∆H = –160 kJ/mol
Sabe-se que a velocidade da reação II é maior que a da reação I. Comparando-se essas duas reações, é CORRETO afirmar que, na II:
A) a energia de ativação é maior.
B) a energia do estado de transição é menor.
C) a energia dos reagentes é maior.
D) a energia liberada na forma de calor é menor.
Questão 05 sobre Gráficos Termocinéticos: (UFMG) Considere os diagramas a seguir, que mostram a variação de energia potencial em função do caminho de três reações diferentes, realizadas na mesma temperatura.
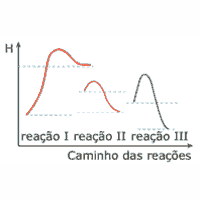
Com relação às reações anteriores, a afirmativa ERRADA é:
A) A energia de ativação da reação I é maior do que a da reação II.
B) A reação I libera mais calor do que a reação II.
C) A reação I é a que apresenta a maior variação de entalpia.
D) As reações II e III são exotérmicas.
E) A reação III deve ser mais lenta do que a reação II.
Questão 06. (UFMG) O gráfico a seguir representa a variação de energia potencial quando o monóxido de carbono, CO, é oxidado a CO2 pela ação do NO2, de acordo com a equação:
CO(g) + NO2(g) → CO2(g) + NO(g)
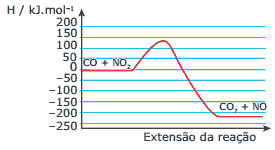
Com relação a esse gráfico e à reação anterior, a afirmativa FALSA é:
A) A energia de ativação para a reação direta é cerca de 135 kJ.mol-1.
B) A reação inversa é endotérmica.
C) Em valor absoluto, o ∆H da reação direta é cerca de 225 kJ.mol-1.
D) Em valor absoluto, o ∆H da reação inversa é cerca de 360 kJ.mol-1.
E) O ∆H da reação direta é negativo.
Questão 07 sobre Gráficos Termocinéticos: (UFC) Os constantes aumentos dos preços dos combustíveis convencionais dos veículos automotores têm motivado a utilização do gás natural (CH4) como combustível alternativo. Analise o gráfico a seguir, que ilustra as variações de entalpia para a combustão do metano.
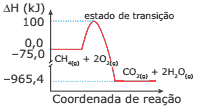
Assinale a alternativa CORRETA.
A) A entalpia de combustão do metano,∆Hc= –890,4 kJ.mol-1, equivale ao valor da somatória das entalpias de formação de um mol de CO2(g) e 2 mol de H2O(g).
B) A energia calorífica consumida para a ativação da reação, 175 kJ.mol-1, é consideravelmente menor do que a energia liberada na combustão do metano, ∆H = –890,4 kJ.mol-1.
C) A reação de combustão do CH4 bem exemplifica um processo exotérmico, com liberação de 965,4 kJ, quando um mol desse gás é consumido para produzir 3 mol de produtos gasosos.
D) A formação do estado de transição envolve uma variação de entalpia de 100 kJ.mol-1, e o calor de combustão do CH4 corresponde ao valor ∆H = –965,4 kJ.mol-1.
E) O cálculo termodinâmico, rigorosamente correto, do calor de combustão do CH 4 envolve todas as etapas representadas no gráfico, isto é, ∆H = (–75 + 100 – 965,4) = –940,4 kJ.mol-1
Questão 08. (UnB-DF) Julgue os itens a seguir relacionados com a figura:
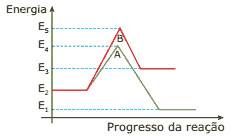
( ) A reação B é endotérmica.
( ) A reação A, no sentido inverso, é exotérmica.
( ) A reação B possui maior energia de ativação do que a reação A.
( ) A reação A teria uma diminuição da energia final E1 se fosse adicionado um catalisador positivo.
( ) A energia correspondente a E5 – E2 é a energia de ativação da reação B.
Questão 09. (UFU-MG–2008) Considere o diagrama de energia a seguir. Ele representa uma reação química que se processa na ausência (I) e na presença (II) de catalisador.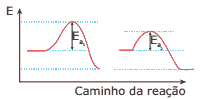
Marque a alternativa CORRETA:
A) A energia de ativação com catalisador é maior do que aquela sem catalisador.
B) Quanto menor for a energia de ativação, menor será a velocidade da reação química.
C) A entalpia do complexo ativado é alterada na reação com catalisador. Esse processo forma um complexo ativado com energia menor do que aquele formado na reação sem catalisador.
D) A reação é endotérmica, pois o conteúdo energético dos produtos é menor do que o conteúdo energético dos reagentes.
Questão 10 sobre Gráficos Termocinéticos: (UFU-MG) O aumento da produção de gases, através da queima de combustíveis fósseis, vem contribuindo para o aquecimento do planeta. Considerando o diagrama que representa a reação de combustão: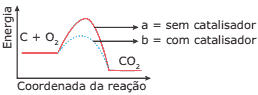
pode-se afirmar que a energia de ativação:
A) é maior, quando a reação se processa no sentido da formação de CO2, sem catalisador.
B) é maior, quando a reação se processa no sentido inverso à formação de CO2, sem catalisador.
C) é maior, quando a reação se processa no sentido da formação de CO2, com catalisador.
D) é maior, quando a reação se processa no sentido inverso à formação de CO2, com catalisador.
E) tem mesmo valor tanto no sentido de formação, quanto no sentido inverso da formação de CO2, com catalisador.
🔵 >>> Confira a lista completa com todos os exercícios de Química.
Gabarito com as respostas das questões de Química sobre Gráficos Termocinéticos:
01. D;
02. Soma = 47;
03. B;
04. B;
05. B;
06. D;
07. B;
08. V, F, V, F, V;
09. C;
10. B
Doutorando em Genética e Biologia Molecular – UESC-BA
Mestre em Genética e Biologia Molecular – UESC-BA
Pós-Graduado em Metodologia do Ensino de Biologia e Química – FAEL
Licenciado em Ciências Biologias – IFMT/Campus Juína
