Questão 01 sobre Pureza química: (Unifesp SP/2008/1ªFase.) A geração de lixo é inerente à nossa existência, mas a destinação do lixo deve ser motivo de preocupação de todos. Uma forma de diminuir a grande produção de lixo é aplicar os três R (Reduzir, Reutilizar e Reciclar). Dentro desta premissa, o Brasil lidera a reciclagem do alumínio, permitindo economia de 95% no consumo de energia e redução na extração da bauxita, já que para cada kg de alumínio são necessários 5 kg de bauxita.
A porcentagem do óxido de alumínio (Al2O3) extraído da bauxita para produção de alumínio é aproximadamente igual a
a) 20,0%.
b) 25,0%.
c) 37,8%.
d) 42,7%.
e) 52,9%.
Questão 02. (Uem PR/2008) A pólvora consiste em uma mistura de substâncias que, em condições adequadas, reagem, com rendimento de 100%, segundo a equação química abaixo:
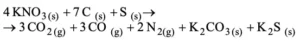
Sob condições normais de temperatura e pressão, e admitindo comportamento ideal para todos os gases, considere a reação de uma amostra de pólvora contendo 1515 g de KNO3 com 80% de pureza.
Calcule o volume total de gases produzidos na reação. Em seguida, nomeie os sais formados.
Questão 03. (Ueg GO/2007/Janeiro) Em uma aula experimental de Química, um aluno provocou a reação entre 80 g de calcário (CaCO3) e excesso de acido clorídrico (HCl). Considerando esse processo laboratorial, responda aos itens abaixo:
Dado: R = 0,082 atm.L.K–1.mol–1
a) Escreva a equação química da reação que descreve o processo.
b) Considerando o grau de pureza do CaCO3 igual a 95%, temperatura e pressão iguais a, respectivamente, 27 ºC e 3 atm, calcule o volume de gás carbônico liberado.
Questão 04 sobre Pureza química: (Uepg PR/2007/Julho) O bicarbonato de sódio, ou carbonato ácido de sódio, é um sal muito utilizado como fermento na preparação de bolos. Esse fermento químico, ao ser aquecido, se decompõe, liberando CO2, além de formar carbonato de sódio sólido e água. Considerando que 100 g de fermento contêm 80% de bicarbonato de sódio, assinale o que for correto.
Dados: Na = 23 g/mol ; C = 12 g/mol ; O = 16 g/mol
01. A quantidade, em mol, de carbonato de sódio formado na reação de decomposição é 0,95 mol.
02. Esta reação favorece o crescimento do bolo, pois a formação de gases faz com que a massa cresça.
04. Quando dissolvido em H2O, o bicarbonato de sódio produz uma solução levemente ácida.
08. A reação de decomposição é a seguinte:![]()
Questão 05. (Ufms MS/2007/Exatas) A revista Pesquisa Fapesp publicou, na sua edição de Junho/2006, uma reportagem sobre o H-Bio diesel, de autoria de Marcos de Oliveira, da qual reproduzimos um trecho. Leia-o e responda à questão a seguir.
Centro de pesquisa da Petrobras desenvolve técnica para uso de óleo vegetal na produção de diesel
Misturar óleo de soja no processo de refino do diesel é a nova tecnologia desenvolvida ao longo de 18 meses por pesquisadores do Centro de Pesquisas e Desenvolvimento (Cenpes) da Petrobras. “É feita a inserção de óleo de soja durante a produção do diesel”, diz Alípio Ferreira Pinto Júnior, gerente-geral de abastecimento do Cenpes. Duas refinarias passam agora por uma adaptação logística para recebimento e armazenamento do óleo de soja, que chegará até elas por caminhão. Essas unidades, além de estarem próximas a centros produtores de soja, possuem estações de hidrotratamento que são fundamentais para produzir o novo diesel, que levará o nome de H-Bio. “Essas estações utilizam o hidrogênio para remover moléculas de enxofre do diesel ”, diz Pinto Júnior .
Menos enxofre – Uma das vantagens inovadoras do H-Bio diesel é que, com a adoção do óleo de soja, é possível eliminar de vez o enxofre existente normalmente neste combustível . Quando jogado na atmosfera, esse elemento pode se transformar em dióxido de enxofre e até em ácido sulfúrico, contribuindo para a chuva ácida. O diesel vendido no Brasil possui entre 0,20% e 0,05% de enxofre. Além de benefícios ambientais, o H-Bio também vai permitir uma melhor ignição. “Ele possui um índice de cetano (que é um componente do diesel) alto e isso indica uma boa qualidade de ignição”, afirma Pinto Júnior. Também chamada de partida a frio, essa função, com bom desempenho, permite uma combustão de melhor qualidade e economia de combustível .
Sabendo-se que: ![]() , calcule a massa, em gramas, de SO2 produzida durante a queima de 1,875 L de óleo diesel (densidade = 0,8 g/mL) contendo 0,2% (m/m) de enxofre, que deixaria de ser lançada na atmosfera com a adoção do H-Bio diesel.
, calcule a massa, em gramas, de SO2 produzida durante a queima de 1,875 L de óleo diesel (densidade = 0,8 g/mL) contendo 0,2% (m/m) de enxofre, que deixaria de ser lançada na atmosfera com a adoção do H-Bio diesel.
Dados: Massas Molares (g/mol): S = 32; O – 16.
Questão 06. (Ufal AL/2007) O óxido de cálcio é obtido segundo a equação representada abaixo e gera durante sua produção grande quantidade de dióxido de carbono.
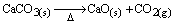
A massa de dióxido de carbono formada partindo-se de 200,0 g de carbonato de cálcio com 90% de pureza é:
Dados:
Massas molares (g mol–1)
Ca ……40
C ……..12
O………16
a) 7,9 g.
b) 8,8 g.
c) 79,2 g.
d) 88,0 g.
e) 96,8 g.
Questão 07 sobre Pureza química: (Uel PR/2007) A osteoporose é uma doença que resulta da carência de cálcio nos ossos, havendo uma redução da massa óssea e deterioração da qualidade dos mesmos. Os ossos ficam cada vez mais porosos e, após alguns anos, ficam suficientemente frágeis e fraturam com facilidade. Uma das medidas de prevenção consiste no fornecimento de cálcio aos ossos nas quantidades que eles necessitam diariamente. Segundo recomendações médicas, um adulto deve ingerir uma dose diária de 800 mg de cálcio. Suponha que um adulto esteja tomando, diariamente, um tablete de 1,30 g de um suplemento nutricional, à base de casca de ostras, o qual contém 82% de carbonato de cálcio.
Com base no texto e nos conhecimentos sobre o carbonato de cálcio, considere as afirmativas a seguir:
I. O carbonato de cálcio não pode ser ingerido porque, sendo um composto covalente, é um sal pouco solúvel em água.
II. O adulto em questão está ingerindo cerca de 53,4% da dose diária recomendada do elemento cálcio.
III. O carbonato de cálcio pode resultar da reação de dupla troca entre um ácido fraco e uma base forte.
IV. O adulto em questão está ingerindo cerca de 65,0% da dose diária recomendada do elemento cálcio.
Assinale a alternativa que contém todas as afirmativas corretas:
a) I e II
b) II e III
c) II e IV
d) III e IV
e) I, III e IV
Questão 08. (Ufpe PE/2007) a partir de um processo de redução em alto forno, usando carvão, C(s), como agente redutor. Uma das reações ocorridas nesse processo é dada pela equação não balanceada: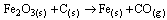
Calcule a massa de Fe(s) (em toneladas) que é possível obter a partir de 100 toneladas de hematita, 70% pura. (Dados: C = 12 g/mol; O = 16 g/mol; Fe = 56 g/mol).
Questão 09. (UFRural RJ/2007) Uma indústria precisa determinar a pureza de uma amostra de hidróxido de sódio (NaOH). Sabendo que 4,0 g da amostra foram neutralizados com 40mL de ácido clorídrico 2 mol/L e que as impurezas presentes na amostra não reagem com o ácido clorídrico, calcule a porcentagem de pureza da base.
Questão 10 sobre Pureza química: (Ufc CE/2006/1ªFase) A porcentagem de TiO2 em um minério pode ser determinada através da seguinte reação:
3TiO2(s) + 4BrF3(l) ® 3TiF4(s) + 2Br2(l) + 3O2(g)
Se 12,0 g do minério produzem 0,96 g de O2, a porcentagem aproximada de TiO2 nesse minério é de:
a) 10%
b) 20%
c) 30%
d) 40%
e) 50%
🔵 >>> Confira a lista completa com todos os exercícios de Química.
Gabarito com as respostas da lista de exercícios sobre Pureza Química para passar no Vestibular e Enem:
01. C;
02. x = 537,6 L; Carbonato de potássio e sulfeto de potássio.
03.
b) 6,232 L
04. 10;
05. 06;
06. C;
07. B;
08. 49;
09. x = 80%;
10. B
Doutorando em Genética e Biologia Molecular – UESC-BA
Mestre em Genética e Biologia Molecular – UESC-BA
Pós-Graduado em Metodologia do Ensino de Biologia e Química – FAEL
Licenciado em Ciências Biologias – IFMT/Campus Juína
