Questão 01 sobre Teoria Quântica Moderna: (UFMG) O modelo atômico atual apresenta uma descrição probabilística para os elétrons. Esse modelo inclui todos os seguintes conceitos, EXCETO:
A) Energias quantizadas.
B) Nêutrons.
C) Núcleos atômicos.
D) Órbitas eletrônicas.
E) Prótons.
Questão 02. (FCMMG–2008) Com relação ao modelo atômico moderno, um estudante fez as seguintes afirmativas:
• A posição de um elétron, no átomo, pode ser determinada com exatidão.
• Em um átomo, os orbitais são regiões do espaço que podem ser ocupadas por elétrons.
• A cada orbital atômico podem ser associados 4 números quânticos com valores definidos.
Analisando as afirmativas do estudante, conclui-se que:
A) nenhuma é correta.
B) todas são corretas.
C) apenas uma é correta.
D) apenas duas são corretas.
Questão 03 sobre Teoria Quântica Moderna: (UFOP-MG) Todas são características comuns ao modelo atômico atual, EXCETO:
A) A órbita dos elétrons não pode ser modificada, quando o átomo absorve energia.
B) O núcleo concentra quase a totalidade da massa do átomo.
C) Os nêutrons minimizam a repulsão entre os prótons.
D) As características do núcleo do átomo não são alteradas em uma reação química.
Questão 04. (UFOP-MG–2008) Considere as seguintes configurações eletrônicas, que podem ser de estado fundamental ou excitado:
• 1s2 2s2 2p1
• 1s2 2s3 2p0
• 1s2 2s1 2p3
• 1s3 2s1
• 1s2 2s1 2p7
• 1s2 2s2 2p6 3s2 3p6 4s2 3d8
De acordo com o Princípio da Exclusão de Pauli, o número de configurações IMPOSSÍVEIS, entre as representadas, é
A) 2.
B) 3.
C) 4.
D) 5.
Questão 05 sobre Teoria Quântica Moderna: (UNIRIO-RJ) Os sais de Cr6+ são, em geral, solúveis no pH biológico e têm fácil penetração. Daí a sua toxidade para seres humanos. Por outro lado, os compostos de Cr3+ são pouco solúveis nesse pH, o que resulta em dificuldade de passar para o interior das células. Indique a alternativa que corresponde à configuração eletrônica do íon Cr3+.
Dados: [Ar] ⇒ Argônio (Z = 18)
A) [Ar] 4s2 3d1
B) [Ar] 3d2
C) [Ar] 3d3
D) [Ar] 4s2 3d4
E) [Ar] 4s1 3d5
Questão 06. (UFF-RJ) O Princípio da Exclusão de Pauli estabelece que:
A) a posição e a velocidade de um elétron não podem ser determinadas simultaneamente.
B) elétrons em orbitais atômicos possuem spins paralelos.
C) a velocidade de toda radiação eletromagnética é igual à velocidade da luz.
D) dois elétrons em um mesmo átomo não podem apresentar os quatro números quânticos iguais.
E) numa dada subcamada que contém mais de um orbital, os elétrons são distribuídos sobre os orbitais disponíveis, com seus spins na mesma direção.
Questão 07 sobre Teoria Quântica Moderna: (UFES) Com relação à estrutura do átomo, é CORRETO afirmar:
A) O número de massa é a soma do número de elétrons mais o número de prótons.
B) O número quântico magnético varia de 0 a (n – 1).
C) O número quântico secundário varia de –1 a +1, passando por zero.
D) No núcleo do átomo, há prótons e nêutrons e, na eletrosfera, elétrons.
E) Quando o número quântico magnético é zero, o número quântico principal pode ser zero ou um.
Questão 08. (UFCG-PB–2008) De acordo com o Princípio de Pauli, cada elétron num átomo deve ter um conjunto diferente de números quânticos: n, l, ml, e ms. Considere a configuração eletrônica do átomo de boro dado a seguir:
1s2 2s2 2px1
Assinale a alternativa em que as afirmativas relacionadas aos números quânticos dos elétrons é INCORRETA.
A) Os três elétrons da camada externa têm o mesmo número quântico secundário.
B) Três elétrons têm o mesmo número quântico principal.
C) Quatro elétrons têm o mesmo número quântico azimutal.
D) Quatro elétrons têm o mesmo número quântico magnético.
E) Três elétrons têm o mesmo número quântico spin.
Questão 09. (UFRN) A luz amarela das lâmpadas de vapor de sódio usadas na iluminação pública é emitida pelo decaimento da energia de elétrons excitados no átomo de sódio. No estado fundamental, um certo elétron desse elemento se encontra no segundo nível de energia, em um orbital p. Os valores dos números quânticos que podem caracterizar esse elétron são:
A) n = 2; l = 1; ml = 2; s = –1/2
B) n = 2; l = 2; ml = –2; s = –1/2
C) n = 2; l = 1; ml = –1; s = +1/2
D) n = 2; l = 0; ml = 0; s = +1/2
Questão 10 sobre Teoria Quântica Moderna: (Cesgranrio) Assinale a alternativa que contraria a Regra de Hund:
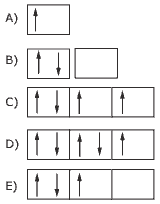
🔵 >>> Confira a lista completa com todos os exercícios de Química.
Gabarito com as respostas das melhores questões de química sobre a Teoria Quântica Moderna:
01. D;
02. C;
03. A;
04. B;
05. C;
06. D;
07. D;
08. A;
09. C;
10. E
Doutorando em Genética e Biologia Molecular – UESC-BA
Mestre em Genética e Biologia Molecular – UESC-BA
Pós-Graduado em Metodologia do Ensino de Biologia e Química – FAEL
Licenciado em Ciências Biologias – IFMT/Campus Juína
