Questão 01 sobre Eletrólise Qualitativa e Quantitativa: (PUC-SP/2008) A eletrólise em série de uma solução aquosa de sulfato de zinco e de uma solução aquosa de iodeto de potássio é esquematizada a seguir.
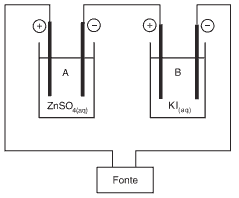
A respeito deste sistema, foram feitas as seguintes afirmações:
I. Nos ânodos (polos +), formam-se zinco metálico e gás hidrogênio.
II. O volume de gás oxigênio (O2) formado no frasco A é a metade do volume de gás hidrogênio (H2) formado no frasco B.
III. A massa de zinco formada no frasco A é igual à massa de iodo formada no frasco B.
IV. A solução resultante no frasco B apresenta pH > 7.
Estão corretas as afirmações
a) I e III.
b) II e IV.
c) I, II e IV.
d) I, II e III.
e) III e IV.
Questão 02. (Uece/2008) A questão a seguir é uma aplicação das leis da eletrólise formuladas por Michael Faraday (1791-1867), químico, físico e filósofo inglês. Três células eletrolíticas, contendo, respectivamente, uma solução com íons de prata (Ag+), uma solução com íons de Cu2+ e uma solução com íons de Au3+, estão conectadas em série. Depois de algum tempo, se depositam 3,68 g de prata metálica na célula que contém íons de Ag+. Ao final, as massas de cobre e de ouro depositadas serão, respectivamente:
a) 0,27 g e 0,66 g.
b) 0,54 g e 1,12 g.
c) 1,08 g e 2,24 g.
d) 2,16 g e 4,48 g.
Questão 03. (ITA/2008) Uma tubulação de aço enterrada em solo de baixa resistividade elétrica é protegida, catodicamente, contra corrosão, pela aplicação de corrente elétrica proveniente de um gerador de corrente contínua. Considere os seguintes parâmetros:
I. Área da tubulação a ser protegida: 480 m2;
II. Densidade de corrente de proteção: 10 mA/m2.
Considere que a polaridade do sistema de proteção catódica seja invertida pelo período de 1 hora. Assinale a opção CORRETA que expressa a massa, em gramas, de ferro consumida no processo de corrosão, calculada em função de íons Fe (aq)2+.
Admita que a corrente total fornecida pelo gerador será consumida no processo de corrosão da tubulação.
a) 1 × 103.
b) 6 × 102.
c) 3 × 101.
d) 5.
e) 20.
Questão 04 sobre Eletrólise Qualitativa e Quantitativa: (UFPI/2003) Pesquisas têm mostrado que os resíduos de dessalinizadores contêm alto teor de cloreto (Cl–) que podem, por processo industrial eletroquímico, usando uma fonte de corrente elétrica, gerar cloro (Cl2) para desinfecção de água de abastecimento. A reação direta no sistema acontece conforme segue-se:
2 Cl-(aq) + 2 H2O(l) → Cl2(g) + H2(g) + 2 OH-(aq)
Analise as afirmativas quanto ao processo eletroquímico e marque a opção correta.
a) O processo industrial é de natureza galvânica.
b) O cloro é obtido no cátodo.
c) Os elétrons fluem do cátodo para o ânodo.
d) O cloro é obtido da reação de oxidação.
e) A reação secundária de formação do hidrogênio acontece no ânodo.
Questão 05. (Unicamp/2009) Ao contrário do que muitos pensam, a medalha de ouro da Olimpíada de Beijing é feita de prata, sendo apenas recoberta com uma fina camada de ouro obtida por deposição eletrolítica. Na eletrólise, a medalha cunhada em prata atua como o eletrodo em que o ouro se deposita. A solução eletrolítica é constituída de um sal de ouro (III). A quantidade de ouro depositada em cada medalha é de 6,0 gramas.
a) Supondo que o processo de eletrólise tenha sido conduzido em uma solução aquosa de ouro (III) contendo excesso de íons cloreto em meio ácido, equacione a reação total do processo eletroquímico. Considere que no ânodo forma-se o gás cloro.
b) Supondo que tenha sido utilizada uma corrente elétrica constante de 2,5 ampères no processo eletrolítico, quanto tempo (em minutos) foi gasto para se fazer a deposição do ouro em uma medalha? Mostre os cálculos.
Dados: constante de Faraday = 96.500 coulomb/mol1; 1 ampère = 1 coulomb/s1.
Questão 06. (Udesc/2009) Uma célula a combustível é um dispositivo de conversão eletroquímica que produz eletricidade a partir de um combustível e um oxidante, que reagem na presença de um eletrólito. Uma das possíveis aplicações desse tipo de células é o uso como fonte de energia para computadores portáteis (“laptops”) e telefones celulares. Nesse caso, o combustível a ser utilizado seria o metanol (CH3OH) reagindo com o oxigênio do ar.
a) Escreva a equação que representa esta reação.
b) Considerando que a entalpia de combustão do metanol é de -720 kJ/mol, qual é a quantidade de metanol, em gramas, necessária para manter um “laptop” que consome 10 W (ou 10 J/s) funcionando por 1 hora, considerando uma conversão energética hipotética de 50%? (O restante é perdido na forma de calor.)
Questão 07 sobre Eletrólise Qualitativa e Quantitativa: (Udesc/2009) O hidrogênio tem sido proposto como o combustível “ecológico”, já que a sua reação de combustão com oxigênio gera apenas água como produto. No entanto, a concentração do gás hidrogênio na atmosfera é muito pequena e ele precisa ser gerado a partir de outras fontes. Uma das maneiras propostas é a eletrólise da água, que em princípio é uma fonte de hidrogênio praticamente inesgotável.
Dado:
1 mol de elétrons corresponde a 96.500 Coulombs.
Formulário: Q = it
a) Escreva a equação que representa a combustão do hidrogênio e a que representa a eletrólise da água.
b) Na eletrólise da água, qual é o tempo necessário para gerar 2,24 m3 de hidrogênio, nas CNTP, utilizando uma corrente elétrica de 1.000 A?
Questão 08. (Ita/2011) Em um experimento eletrolítico, uma corrente elétrica circula através de duas células durante 5 horas. Cada célula contem condutores eletrônicos de platina. A primeira célula contem solução aquosa de íons Au3+ enquanto que, na segunda célula, esta presente uma solução aquosa de íons Cu2+.
Sabendo que 9,85 g de ouro puro foram depositados na primeira célula, assinale a opção que corresponde a massa de cobre, em gramas, depositada na segunda célula eletrolítica.
a) 2,4
b) 3,6
c) 4,8
d) 6,0
e) 7,2
Questão 09. (Ufpb/2011) A importância da indústria brasileira de alumínio no cenário mundial é demonstrada por sua participação no mercado global. Além de ser o sexto maior produtor desse metal, o Brasil possui a terceira maior jazida de bauxita do planeta. Da bauxita se extrai a alumina, matéria-prima para a fabricação do alumínio. O processo químico utilizado na produção industrial do alumínio consiste na eletrólise de uma mistura fundida de alumina (Al2O3) e criolita (Na3AlF6), conforme o esquema a seguir.
A partir do esquema, identifique as afirmativas corretas relativas a esse processo de fabricação de alumínio:
( ) O alumínio é gerado no cátodo da célula eletrolítica.
( ) O carbono é reduzido no ânodo da célula eletrolítica.
( ) O processo ocorre com a redução de Al3+ .
( ) O processo ocorre na superfície dos eletrodos de grafite.
( ) Os eletrodos de grafite são inertes.
Questão 10 sobre Eletrólise Qualitativa e Quantitativa: (Unicamp/2011) Uma maneira de se produzir ferro metálico de uma forma “mais amigável ao meio ambiente” foi desenvolvida por dois cientistas, um norte-americano e um chinês, que constataram a surpreendente solubilidade dos minérios de ferro em carbonato de lítio líquido, em temperaturas ao redor de 800°C. No processo, a eletrólise dessa solução, realizada com uma corrente elétrica de alta intensidade, leva a separação dos elementos que compõem os minérios e a produção do produto desejado.
a) O artigo que relata a descoberta informa que os elementos que formam o minério são produzidos separadamente em dois compartimentos, na forma de substâncias elementares. Que substâncias são essas? Dê os nomes e as fórmulas correspondentes.
b) O processo atual de obtenção de ferro consiste na utilização de alto forno, que funciona a uma temperatura entre 1300 e 1500°C, com adição de carbono para a reação de transformação do minério. Considerando todas as informações dadas, apresente duas diferenças entre o processo atual e o novo. Explique, separadamente, como essas diferenças justificam que o novo processo seja caracterizado como “mais amigável ao meio ambiente”.
🔵 >>> Confira a lista completa com todos os exercícios de Química.
Gabarito com as respostas das questões de química sobre Eletrólise Qualitativa e Quantitativa:
01. b;
02. c;
03. d;
04. d;
5) a) Au3+ + 3 Cl– → Au + 3/2 Cl2
b) Au3+ + 3 e– → Au
197 g de Au ____ 3 × 96.500 C
6 g de Au _____ Q
Q = 8.817 C
2,5 C ____ 1s
8.817 C ____ t (tempo)
t (tempo) = 3.527 s = 58,8 minutos.
06. a) CH3OH + 2 O2 → 2 H2O + CO2.
b) 0,8 g de metanol (CH3OH).
07. a) Representação da reação de combustão do hidrogênio:
H2 +1/2 O2 → H2O ou 2 H2 + 1 O2 → 2 H2O.
Representação da reação de eletrólise da água:
H2O → H2 + 1/2 O2 ou 2 H2O → 2 H2 + 1 O2.
b) t = 5,36 horas.
08. c
A carga elétrica é a mesma nas duas células. Então:
Au– + 3 e– → Au
3 mols e– –– 196,97 g
n mols e– –– 9,85 g
n mols e– = 0,15 mol
Como temos 0,15 mol de elétrons, vem:
Cu2+ + 2 e– → Cu
2 mols e– –– 63,55 g
0,15 mols e– –– m
mCu = 4,766 g = 4,8 g
09. V – F – V – V – F.
Análise das afirmativas:
(V) Afirmativa correta: o alumínio é gerado no cátodo da célula eletrolítica;
(F) Afirmativa incorreta: o carbono sofre oxidação;
(V) Afirmativa correta: o processo ocorre com a redução de Al3+ ;
(V) Afirmativa correta: o processo ocorre na superfície dos eletrodos de grafite;
(F) Afirmativa incorreta: os eletrodos de grafite não são inertes.
10. a) Ferro metálico: Fe.
Oxigênio gasoso: O2.
b) O processo atual de obtenção do ferro exige uma temperatura entre 1300 e 1500°C e emite CO2, que contribui para o efeito estufa.
O processo novo requer uma temperatura menor (800°C), consequentemente consome menos energia.
Doutorando em Genética e Biologia Molecular – UESC-BA
Mestre em Genética e Biologia Molecular – UESC-BA
Pós-Graduado em Metodologia do Ensino de Biologia e Química – FAEL
Licenciado em Ciências Biologias – IFMT/Campus Juína
