Questão 01 sobre Constantes de Equilíbrio: (UEL-PR–2008) A figura seguinte representa a quantidade de moléculas de frutose e glicose, em solução aquosa, a 25 ºC e em equilíbrio químico, de acordo com a equação:
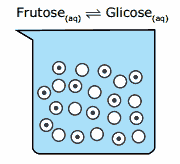
![]() Representação de 1 molécula de frutose
Representação de 1 molécula de frutose![]() Representação de 1 molécula de glicose
Representação de 1 molécula de glicose
A constante de equilíbrio a 25 ºC para a reação é igual a Dados: Volume da solução = 3,0 L .
A) 0,40.
B) 0,83.
C) 0,28.
D) 1,20.
E) 1,00.
Questão 02. (PUC Minas–2010) Na tabela a seguir, assinale a reação que MAIS favorece o produto.

Questão 03. (UFMG) 0,80 mol.L–1 de A são misturados com 0,80 mol.L-1 de B. Esses dois compostos reagem lentamente, produzindo C e D, de acordo com a reação:
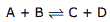
Quando o equilíbrio foi atingido, a concentração de C foi medida, tendo sido encontrado o valor 0,60 mol.L-1. A constante de equilíbrio, Kc, dessa reação é:
A) 1,7.
B) 0,45.
C) 5,3.
D) 9,0.
E) 3,0.
Questão 04 sobre Constantes de Equilíbrio: (FCMMG–2011) Colocaram para reagir, em um recipiente vazio, fechado, de volume constante, 1,0 mol de H2(g) e 1,0 mol de I2(g). Na temperatura em que ocorre a reação:
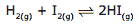
a constante de equilíbrio é igual a 1,0.
Tendo-se em vista o exposto, pode-se concluir que a quantidade de HI(g) presente no equilíbrio é igual a:
A) 0,33 mol.
B) 0,50 mol.
C) 0,66 mol.
D) 2,0 mol.
Questão 05. (UNIRIO-RJ) O conceito de equilíbrio é fundamental na Química, mas não é exclusivo da Química. Vivemos em uma situação social e econômica que constitui equilíbrio dinâmico de forças competitivas. Na família e nos grupos sociais, comportamo-nos de maneira a manter as relações mais cordiais possíveis. Na realidade, procuramos atingir um equilíbrio.
Kotz; Treichel, 1998.
Acerca do tema equilíbrio químico, podemos afirmar que:
A) quanto menor for a constante de equilíbrio, mais favorável será a formação dos produtos.
B) a constante de equilíbrio não é alterada quando são alterados os coeficientes estequiométricos da equação.
C) a adição de um catalisador altera o valor da constante de equilíbrio.
D) o estado físico das substâncias deve ser levado em consideração na expressão da constante de equilíbrio.
E) quanto maior for a constante de equilíbrio, mais favorável será a regeneração dos reagentes.
Questão 06. (Unimontes-MG–2009) Os gases oxigênio (O2) e nitrogênio (N2) presentes no ar atmosférico podem reagir, durante a combustão da gasolina, no motor de um automóvel. A equação para a reação de equilíbrio é dada por:
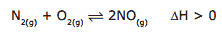
À temperatura ambiente, a constante de equilíbrio é igual a 4,8×10–31. Considerando o equilíbrio dado, é INCORRETO afirmar que:
A) a decomposição do NO é favorecida em temperaturas mais baixas.
B) o valor da constante de equilíbrio é quadruplicado ao se dobrar a [NO].
C) o aquecimento do motor contribui para a formação de NO.
D) a concentração de NO, à temperatura ambiente, é muito baixa.
Questão 07. (FCMMG–2011) A certa temperatura, 2,0 mol de COCℓ2(g) foram colocados em um frasco de volume constante e igual a 1,0 L. Esse composto dissociou-se segundo a reação:
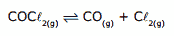
No equilíbrio, 50% de COCℓ2(g) estava dissociado.
A quantidade de matéria de COCℓ2(g) que deve ser colocada no mesmo frasco de 1,0 L para que 25% do COCℓ2(g) total se dissocie, na mesma temperatura, é igual a:
A) 12 mol.
B) 4,0 mol.
C) 1,0 mol.
D) 0,083 mol.
Questão 08 sobre Constantes de Equilíbrio: (UFMG) Quando um mol de amônia é aquecido em um sistema fechado, a uma determinada temperatura, 50% do composto se dissocia, estabelecendo-se o equilíbrio.
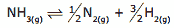
A soma das quantidades de matéria, em mols, das substâncias presentes na mistura em equilíbrio é:
A) 3,0.
B) 2,5.
C) 2,0.
D) 1,5.
E) 1,0.
Questão 09. (FUVEST-SP) A transformação de um composto A em um composto B, até se atingir o equilíbrio (A B), foi estudada em três experimentos. De um experimento para o outro, variou-se a concentração inicial do reagente A, ou a temperatura, ou ambas. Registraram-se as concentrações de reagente e produto em função do tempo.
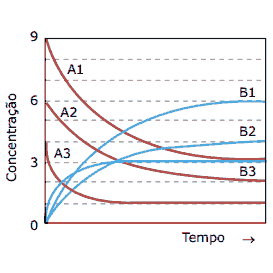
Com esses dados, afirma-se:
I. Os experimentos 1 e 2 foram realizados à mesma temperatura, pois as constantes de equilíbrio correspondentes são iguais.
II. O experimento 3 foi realizado em uma temperatura mais elevada que o experimento 1, pois no experimento 3 o equilíbrio foi atingido em um tempo menor.
III. A reação é endotérmica no sentido da formação do produto B.
Dessas afirmações:
A) todas são corretas.
B) apenas I e III são corretas.
C) apenas II e III são corretas.
D) apenas I é correta.
E) apenas II é correta.
Questão 10. (ENEM) Jogadores de futebol e alpinistas necessitam de um período de aclimatação, a fim de se minimizarem os efeitos das grandes altitudes. Nesse tipo de situação, o ar é rarefeito e a baixa quantidade de oxigênio acarreta alguns desconfortos físicos, tais como dores de cabeça, fadiga, náuseas e, em casos mais graves, o indivíduo pode entrar no estado de coma, o que pode levá-lo ao óbito. A hemoglobina é a responsável pelo transporte de oxigênio inalado para as células de nosso organismo na forma de oxiemoglobina. Esse processo é representado pela equação não balanceada:
Hemoglobina(aq) + O2(g) Oxiemoglobina(aq)
Durante o período de aclimatação, o organismo aumenta a taxa de produção de hemoglobina, restabelecendo os níveis de oxigenação nas células e:
A) ocorre o aumento da constante de equilíbrio da reação de síntese da oxiemoglobina.
B) a constante de equilíbrio da reação de síntese da oxiemoglobina não se altera.
C) ocorre a diminuição da constante de equilíbrio da reação de síntese da oxiemoglobina.
D) ocorre um aumento da pressão parcial do O2(g) e da concentração de oxiemoglobina.
E) ocorre uma diminuição da pressão parcial do O2(g) e da concentração de oxiemoglobina.
Questão 11. (FUVEST-SP) A altas temperaturas, N2 reage com O2 produzindo NO, um poluente atmosférico.
N2(g) + O2(g) 2NO(g)
À temperatura de 2 000 K, a constante de equilíbrio anterior é igual a 4,0×10-4. Nessa temperatura, se as concentrações de equilíbrio de N2 e O2 forem, respectivamente, 4,0×10-3 e 1,0×10-3 mol.L-1, qual será a de NO?
A) 1,6×10-9 mol.L-1
B) 4,0×10-9 mol.L-1
C) 1,0×10-5 mol.L-1
D) 4,0×10-5 mol.L-1
E) 1,6×10-4 mol.L-1
Questão 12 sobre Constantes de Equilíbrio: (Fatec-SP) Considere a mistura gasosa em equilíbrio, a 450 ºC, contida em um recipiente de 1,0 L.
H2(g) + I2(g) 2HI(g)
No instante t, o sistema sofreu uma perturbação que conduziu a um novo estado de equilíbrio:
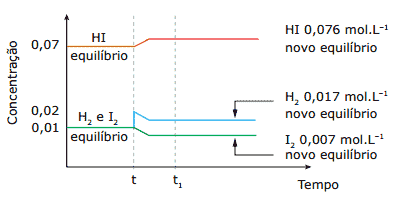
Analisando o gráfico e sabendo que a temperatura e a pressão durante o experimento foram mantidas constantes, podemos afirmar que:
A) os valores da constante Kc nos instantes t e t1 são iguais.
B) a concentração de I2, no equilíbrio inicial, é 0,02 mol.L-1.
C) no instante t1, a concentração de HI é duplicada.
D) no instante t1, constata-se a presença de 0,07 mol.L-1 de H2.
E) no instante t, a concentração de H2 foi reduzida à metade.
Questão 13. (Unimontes-MG–2010) A amônia (NH3) é um produto comercial muito importante na indústria para a produção de compostos nitrogenados e é obtida pelo processo Harber, segundo a equação:
N2(g) + 3H2(g) 2NH3(g)
O gráfico a seguir mostra como a concentração de NH3, na mistura em equilíbrio, varia com a temperatura, a duas pressões diferentes, P1 e P2.
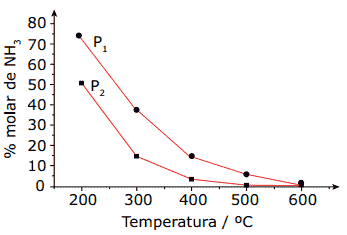
A partir da análise do gráfico e do equilíbrio químico considerado, pode-se afirmar que:
A) o valor da constante de equilíbrio não varia ao longo de uma isóbara.
B) as concentrações de N2 e H2 são iguais em P1 e P2, a 200 ºC.
C) a pressão usada no experimento na curva P1 é maior do que na P2.
D) a constante de equilíbrio em P2 é menor do que em P1 a 400 ºC.
Questão 14 sobre Constantes de Equilíbrio: (FUVEST-SP–2008) Certas quantidades de água comum (H2O) e de água deuterada (D2O) – água que contém átomos de deutério em lugar de átomos de hidrogênio – foram misturadas. Ocorreu a troca de átomos de hidrogênio e de deutério, formando-se moléculas de HDO e estabelecendo-se o equilíbrio (estado I).
H2O + D2O 2HDO
As quantidades, em mols, de cada composto no estado I estão indicadas pelos patamares, a seguir, no diagrama. Depois de certo tempo, mantendo-se a temperatura constante, acrescentou-se mais água deuterada, de modo que a quantidade de D2O, no novo estado de equilíbrio (estado II), fosse o triplo daquela antes da adição. As quantidades, em mols, de cada composto envolvido no estado II, estão indicadas pelos patamares, a seguir, no diagrama.
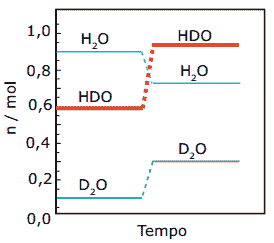
A constante de equilíbrio, nos estados I e II, tem, respectivamente, os valores:
A) 0,080 e 0,25.
B) 4,0 e 4,0.
C) 6,6 e 4,0.
D) 4,0 e 12.
E) 6,6 e 6,6.
🔵 >>> Confira a lista completa com todos os exercícios de Química.
Gabarito com as respostas dos exercícios de Química sobre Constantes de Equilíbrio:
01. D;
02. B;
03. D;
04. C;
05. D;
06. B;
07. A
08. D;
09. A;
10. B;
11. D;
12. A;
13. C;
14. B
Doutorando em Genética e Biologia Molecular – UESC-BA
Mestre em Genética e Biologia Molecular – UESC-BA
Pós-Graduado em Metodologia do Ensino de Biologia e Química – FAEL
Licenciado em Ciências Biologias – IFMT/Campus Juína
