Questão 01 sobre Conceito de Equilíbrio Químico: UFRN – Observe o gráfico abaixo, relativo ao estabelecimento do equilíbrio de uma reação, a 298K, do tipo:
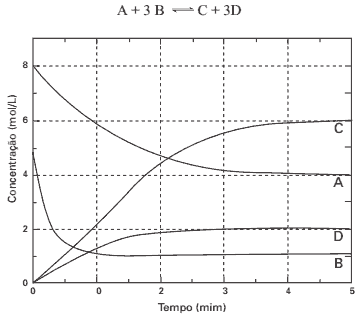
O valor de constante de equilíbrio (Kc) para essa reação, a 298K, é:
a) 3
b) 6
c) 12
d) 24
Questão 02. U. Alfenas-MG – Na tabela abaixo estão mostrados os dados referentes à reação química.
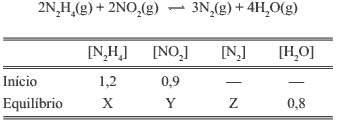
Os valores de X, Y e Z são, respectivamente:
a) 0,40; 0,40 e 0,60
b) 0,80; 0,50 e 0,60
c) 0,80; 0,40 e 0,50
d) 0,40; 0,25 e 0,30
e) 0,60; 0,30 e 0,60
Questão 03 sobre Conceito de Equilíbrio Químico: UFPR – Considere a situação ilustrada e descrita a seguir.
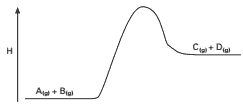
A figura acima representa o diagrama de entalpia de uma reação, cuja equação balanceada, no estado de equilíbrio, é:
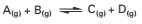
Suponha dois recipientes fechados, I e II, de volumes iguais e na mesma temperatura T. São colocados 1 mol de A e 1 mol de B no recipiente I; 1 mol de C e 1 mol de D no recipiente II (figura abaixo). A temperatura T nos dois recipientes é mantida constante.
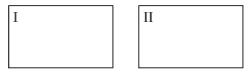
Sobre a reação acima, é correto afirmar:
( ) A energia de ativação é a mesma nos dois sentidos da reação.
( ) O conteúdo energético de C + D é maior que o de A + B.
( ) A constante de equilíbrio químico, K, da reação, é igual a 1.
( ) Para que a temperatura T seja mantida constante no recipiente II, é necessário que haja transferência de calor para o ambiente.
( ) A utilização de um catalisador desloca o estado de equilíbrio no sentido do maior rendimento de C e D.
( ) Quando a reação atinge o estado de equilíbrio nos recipientes I e II, a concentração de A, em mol L-1, no recipiente I, será igual à concentração de B, em mol L-1, no recipiente II.
Questão 04. U. F. Santa Maria-RS – O valor da constante de equilíbrio para a reação:
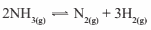
quando 3 mols/L de NH3 produzem 2 mols/L de N2 e 3 mols/L de H2, é, em mol/L:
a) 6.
b) 3.
c) 2.
d) 0,303.
e) 0,104
Questão 05 sobre Conceito de Equilíbrio Químico: U. Caxias do Sul-RS – O gráfico abaixo representa o acompanhamento da concentração dos reagentes e dos produtos de uma reação tipo A(aq) + B(aq) C(aq) + D(aq), que ocorre no sentido da esquerda para a direita, partindo do tempo zero.
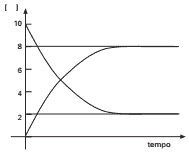
Considerando que o gráfico mostra que as concentrações dos reagentes são sempre iguais entre si, assim como as concentrações dos produtos, é correto afirmar que a constante de equilíbrio dessa reação é igual a:
a) 1/16.
b) 1/4.
c) 4.
d) 5.
e) 16.
Questão 06. Ita-SP – Os gases CO2, H2 reagem entre si formando CO e H2O segundo o equilíbrio:
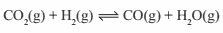
Foram realizados dois experimentos envolvendo esses gases em um recipiente fechado e, após atingido o equilíbrio, determinou-se a concentração de cada gás. A tabela abaixo resume os dados experimentais.
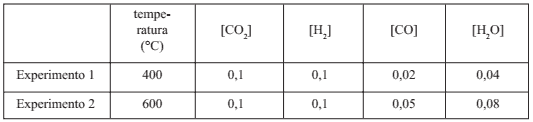
A análise desses dados permite afirmar que:
a) a reação entre CO2 e H2 é um processo endotérmico.
b) a reação entre CO2 e H2 apresenta Kc igual a 12,5 a 400 °C.
c) a reação entre CO2 e H2 apresenta Kc igual a 2,5 a 600 °C.
d) o Kc da reação entre CO2 e H2 independe da temperatura.
e) o Kc da reação entre CO2 e H2 depende do catalisador utilizado no sistema.
Questão 07 sobre Conceito de Equilíbrio Químico: UEL-PR – Para o equilíbrio 2 NbCl4(g) NbCl3(g) + NbCl5(g), obteve-se, a 1,0 x 103 kelvins, as pressões parciais:
NbCl4 = 1,0 x 10-2atm
NbCl3 = 5,0 x 10-3atm
NbCl5 = 1,0 x 10-4atm
Com esses dados calcula-se o valor da constante, Kp, do equilíbrio acima. Seu valor numérico é:
a) 1,0 x 10-3
b) 1,0 x 10-5
c) 5,0 x 10-3
d) 5,0 x 10-5
e) 5,0 x 10-7
Questão 08. Fuvest-SP – No gráfico, estão os valores das pressões parciais de NO2 e de N2O4, para diferentes misturas desses dois gases, quando, a determinada temperatura, é atingido o equilíbrio:
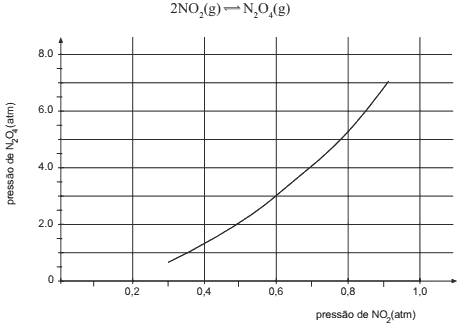
Com os dados desse gráfico, pode-se calcular o valor da constante (Kp) do equilíbrio atingido, naquela temperatura. Seu valor numérico é próximo de:
a) 1
b) 2
c) 4
d) 8
e) 12
Questão 09. UEMS – No equilíbrio 2CO(g) + O2(g) 2CO2(g), temos as seguintes concentrações molares: 4 mol ⋅ L-1 de CO(g) e 4 mol . L-1 de O2(g). Sabendo-se que nestas condições Kc vale10-2, a concentração molar de CO2(g) é:
a) 0,8 mol ⋅ L-1
b) 0,16 mol ⋅ L-1
c) 0,4 mol ⋅ L-1
d) 8,0 mol ⋅ L-1
e) 0,64 mol ⋅ L-1
Questão 10 sobre Conceito de Equilíbrio Químico: U. Católica de Salvador-BA – A produção de carbeto de silício, importante material refratário, envolve o equilíbrio representado por:
SiO (l) + 3C(s) SiC(s) + 2 CO (g)
A expressão da constante desse equilíbrio é dada por:
a) [SiC] / [SiO2]
b) [CO]2 /[C]
c) [CO]2 / [SiO2]
d) [CO]
e) [CO]2
🔵 >>> Confira a lista completa com todos os exercícios de Química.
Gabarito com as respostas dos exercícios sobre Conceito de Equilíbrio Químico:
01. C;
02. B;
03. F, V, F, V, F, V;
04. A;
05. E;
06. A;
07. C;
08. D;
09. A;
10. E
Doutorando em Genética e Biologia Molecular – UESC-BA
Mestre em Genética e Biologia Molecular – UESC-BA
Pós-Graduado em Metodologia do Ensino de Biologia e Química – FAEL
Licenciado em Ciências Biologias – IFMT/Campus Juína
