Questão 01 sobre Hipótese de Avogadro, Equação de Clapeyron e Densidade Gasosa: (FMTM-MG) Os recipientes I, II, III e IV contêm substâncias gasosas nas mesmas condições de temperatura e de pressão.
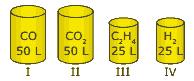
O Princípio de Avogadro permite-nos afirmar que o número:
A) de átomos de oxigênio é maior em I.
B) de átomos de hidrogênio é igual em III e IV.
C) de átomos de carbono é maior em I.
D) total de átomos é igual em III e IV.
E) total de átomos é igual em II e III.
Questão 02. (FCMMG) 1 mol de CH4, gerado por um biodigestor, é submetido a uma sequência de transformações, representadas no diagrama a seguir. Considerando que o gás se comporta idealmente, e que o ponto I do diagrama representa o sistema nas CNTP, pode-se afirmar:
Dado: R = 0,082 atm.L.K-1.mol-1
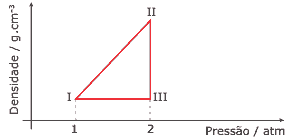
A) A densidade do gás no ponto I é aproximadamente 0,71 g.L-1.
B) A temperatura do ponto II é maior do que a temperatura do ponto III.
C) O volume do gás no ponto III é maior do que no ponto I.
D) A etapa III → I corresponde a uma transformação isobárica.
Questão 03. (Fatec-SP–2006) Algumas companhias tabagistas já foram acusadas de adicionarem amônia aos cigarros, numa tentativa de aumentar a liberação de nicotina, o que fortalece a dependência. Suponha que uma amostra de cigarro libere 2,0×10-4 mol de amônia, a 27 ºC e 1 atm.
Dado: R = 0,082 atm.L.K-1.mol-1
O volume de NH 3 gasoso, em mL, será, aproximadamente:
A) 49.
B) 4,9.
C) 0,49.
D) 0,049.
E) 0,0049.
Questão 04 sobre Hipótese de Avogadro, Equação de Clapeyron e Densidade Gasosa: (Unicamp-SP) Um balão meteorológico de cor escura, no instante de seu lançamento, contém 100 mol de gás hélio (He). Após ascender a uma altitude de 15 km, a pressão do gás se reduziu a 100 mmHg e a temperatura, devido à irradiação solar, aumentou para 77 ºC. CALCULE nessas condições
A) o volume do balão meteorológico.
B) a densidade do He em seu interior.
Dados: R = 62 mmHg.L.mol–1.K-1
Massa molar do He = 4 g.mol-1
Questão 05. (FAAP–SP) Com o objetivo de determinar a massa molecular de um gás A, um pesquisador introduziu em um recipiente de volume V, que se encontrava inicialmente vazio, 15,0 g do referido gás e observou o surgimento de uma pressão p, à temperatura T. A seguir, utilizando outro recipiente de volume igual ao do primeiro, verificou que era necessário introduzir a massa de 1,0 g de H2 para que, à mesma temperatura, fosse gerada a mesma pressão observada no primeiro recipiente.
CALCULE a massa molecular do gás em estudo. Dado: H = 1
Questão 06. (UERJ–2011) A bola utilizada em uma partida de futebol é uma esfera de diâmetro interno igual a 20 cm. Quando cheia, a bola apresenta, em seu interior, ar sob pressão de 1,0 atm e temperatura de 27 ºC. Considere π = 3, R = 0,080 atm.L.mol-1.K-1 e, para o ar, comportamento de gás ideal e massa molar igual a 30 g.mol-1.
No interior da bola cheia, a massa de ar, em gramas, corresponde a:
A) 2,5
B) 5,0
C) 7,5
D) 10,0
Questão 07 sobre Hipótese de Avogadro, Equação de Clapeyron e Densidade Gasosa: (UNIFESP–2007) A figura a seguir representa um experimento de coleta de 0,16 g de gás oxigênio em um tubo de ensaio inicialmente preenchido com água destilada a 27 ºC.
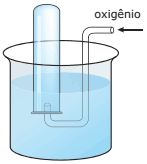
Quando o nível da água dentro do tubo de ensaio é o mesmo que o nível de fora, a pressão no interior do tubo é de 0,86 atm. Dadas a pressão de vapor (H2O) a 27 ºC = 0,040 atm e R = 0,082 atm.L.K-1.mol-1, o volume de gás, em mL, dentro do tubo de ensaio, é igual a
A) 30.
B) 140.
C) 150.
D) 280.
E) 300.
Questão 08. (UEG) Nos parques, as crianças se divertem (e às vezes se entristecem) com os balões que sobem espontaneamente no ar. Esses balões são, em geral, inflados com hidrogênio (H2), que é o gás mais “leve” que se conhece. […] Como este gás é muito inflamável, usa-se atualmente o gás hélio (He).
FELTRE, R. Química geral. 5 ed. São Paulo: Moderna, 2000.
Para encher balões de borracha coloridos, um vendedor ambulante comprou um cilindro de gás hélio com 10,0 L, que apresenta, à temperatura ambiente de 27 ºC, uma pressão de 200 atm.
Dado: Constante dos gases ideais = 0,082 atm.L.mol-1.K-1 responda:
A) Qual a massa de hélio contida no cilindro, supondo uma temperatura ambiente de 27 ºC?
B) Supondo que cada balão cheio contenha em média 3,0 L de hélio a uma pressão de 2 atm, a uma temperatura ambiente de 27 ºC, quantos balões poderão ser enchidos com o gás do cilindro adquirido, na mesma temperatura?
Questão 09. (UFAM–2009) Dois recipientes de igual capacidade contêm massas iguais de gás nitrogênio e gás oxigênio, em condições ideais. A que temperatura deve ser mantido o gás oxigênio para que a sua pressão seja igual a do gás nitrogênio do outro recipiente cuja temperatura é de 7 ºC? Desconsidere a variação da capacidade dos recipientes com a temperatura.
Dados: O = 16 u; N = 14 u
A) 320 K
B) 280 K
C) 273 K
D) 303 K
E) 345 K
Questão 10 sobre Hipótese de Avogadro, Equação de Clapeyron e Densidade Gasosa: (Enem–2002) Numa área de praia, a brisa marítima é uma consequência da diferença no tempo de aquecimento do solo e da água, apesar de ambos estarem submetidos às mesmas condições de irradiação solar. No local (solo) que se aquece mais rapidamente, o ar fica mais quente e sobe, deixando uma área de baixa pressão, provocando o deslocamento do ar da superfície que está mais fria (mar).
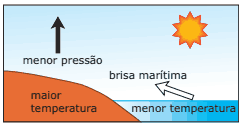
À noite, ocorre um processo inverso ao que se verifica durante o dia.

Como a água leva mais tempo para esquentar (de dia), mas também leva mais tempo para esfriar (à noite), o fenômeno noturno (brisa terrestre) pode ser explicado da seguinte maneira:
A) O ar que está sobre a água se aquece mais; ao subir, deixa uma área de baixa pressão, causando um deslocamento de ar do continente para o mar.
B) O ar mais quente desce e se desloca do continente para a água, a qual não conseguiu reter calor durante o dia.
C) O ar que está sobre o mar se esfria e dissolve-se na água; forma-se, assim, um centro de baixa pressão, que atrai o ar quente do continente.
D) O ar que está sobre a água se esfria, criando um centro de alta pressão que atrai massas de ar continental.
E) O ar sobre o solo, mais quente, é deslocado para o mar, equilibrando a baixa temperatura do ar que está sobre o mar.
🔵 >>> Confira a lista completa com todos os exercícios de Química.
Gabarito com as respostas da lista de questões sobre Hipótese de Avogadro, Equação de Clapeyron e Densidade Gasosa:
01. E;
02. A;
03. B;
04. A) V = 21 700 L
B) dHe = 0,018 g.L-1
05. 30 u;
06. B;
07. C;
08. A) m(He) = 325,2 g
B) 333 balões
09. A ;
10 A
Doutorando em Genética e Biologia Molecular – UESC-BA
Mestre em Genética e Biologia Molecular – UESC-BA
Pós-Graduado em Metodologia do Ensino de Biologia e Química – FAEL
Licenciado em Ciências Biologias – IFMT/Campus Juína
