Questão 01 sobre Lei de Faraday e Eletrólise: (UFMG) Depois do ferro, o alumínio é o metal mais utilizado no mundo. Ele é produzido, industrialmente, pela redução eletrolítica da alumina, Aℓ2O3. As semirreações de eletrodo e a reação total são, respectivamente:
I Aℓ2O3 → 2Aℓ3+ + 1,5O2 + 6e–
II Aℓ2O3 + 6e– → 2Aℓ + 3O2–
__________________________
III Aℓ2O3 → 2Aℓ + 1,5O2
Com relação à eletrólise da alumina, pode-se afirmar, CORRETAMENTE, que
A) a reação total libera energia.
B) na semirreação I ocorre oxidação do alumínio.
C) na semirreação II ocorre redução do oxigênio.
D) na reação total III alumínio é o agente oxidante.
E) na reação total a proporção é de 1 mol de alumina para 3 mol de oxigênio molecular.
Questão 02. (UFMG) O sódio é obtido pela eletrólise do cloreto de sódio fundido segundo a equação
2NaCℓ(ℓ) → 2Na(s) + Cℓ2(g)
Para abaixar o elevado ponto de fusão do cloreto de sódio, adiciona-se cloreto de cálcio, que é eletrolisado simultaneamente segundo a equação
CaCℓ2(ℓ) → Ca(s) + Cℓ2(g)
Em relação a esse processo, todas as alternativas estão corretas, EXCETO:
A) A produção de um mol de cloro requer um mol de elétrons.
B) A redução do íon sódio é um processo endotérmico.
C) O cloro é obtido no ânodo.
D) O estado de oxidação do cálcio varia na eletrólise.
E) Uma mistura de cálcio e sódio é obtida no cátodo.
Questão 03 sobre Lei de Faraday e Eletrólise: (UFMG) A eletrólise da salmoura é o método mais empregado para a produção de soda cáustica (NaOH) e cloro. A reação global do processo é representada pela equação
NaCℓ(aq) + H2O(ℓ) → NaOH(aq) + 12H2(g) + 12Cℓ2(g)
Sobre essa reação, pode-se afirmar que:
A) a água é oxidada.
B) o cloro é oxidante.
C) o íon hidrogênio é reduzido.
D) o oxigênio é redutor.
E) o sódio é oxidado.
Questão 04. (UFMG) As figuras a seguir correspondem a processos eletrolíticos.
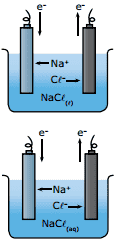
Assinale a afirmativa ERRADA sobre tais processos.
A) Na eletrólise do cloreto de sódio fundido, formam-se sódio livre e cloro gasoso.
B) Eletrolisando-se uma solução aquosa de cloreto de sódio, tem-se H2(g) e Cℓ2(g), além de uma solução aquosa de NaOH.
C) Na eletrólise de uma solução aquosa de cloreto de sódio em que se misturam o cloro e o hidróxido formados, tem-se 2NaOH + Cℓ2 → NaCℓO + NaCℓ + H2O, a frio.
D) Em qualquer dos processos anteriores, a quantidade de cloreto de sódio que se decompõe varia diretamente com a quantidade de eletricidade consumida.
E) Para se decompor 1 mol de NaCℓ, gasta-se a mesma quantidade de eletricidade que para decompor 1 mol de CaCℓ2.
Questão 05 sobre Lei de Faraday e Eletrólise: (FCMMG–2011) Considere o experimento em que a mesma fonte fornece energia elétrica para tubos de ensaio com conteúdos diferentes, inicialmente à mesma temperatura (veja figura). Ambos os béqueres contêm, inicialmente, iguais volumes de água.
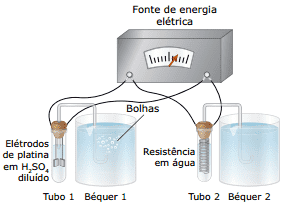
Em relação aos fenômenos que ocorrem nesse experimento, a afirmativa ERRADA é:
A) A energia elétrica provoca transformações químicas no tubo 1.
B) O volume de água no béquer 2 aumenta com o decorrer do tempo.
C) As bolhas que se formam no béquer 1 contém hidrogênio e oxigênio.
D) As temperaturas dos tubos 1 e 2 permanecem iguais durante o experimento.
Questão 06. (UFMG) Fez-se a eletrólise da água acidulada com H2SO4 em um voltâmetro, como indica a figura a seguir. Após interromper o circuito, o tubo I continha 20 mL de gás, e o tubo II continha 10 mL de gás.
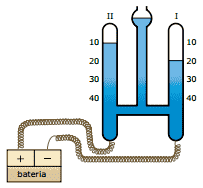
Assinale a afirmação ERRADA.
A) O tubo I contém hidrogênio e algum vapor de água.
B) O número de mols de hidrogênio formado é o dobro do de oxigênio.
C) A massa de ácido sulfúrico diminui durante a eletrólise.
D) A eletrólise também ocorreria se a solução contivesse nitrato de sódio ao invés de H2SO4.
E) As pressões dos gases nos tubos I e II são iguais.
Questão 07 sobre Lei de Faraday e Eletrólise: (UFMG) O alumínio é o segundo metal mais utilizado no mundo. Sua resistência à corrosão é devida à camada aderente e impermeável de óxido que se forma sobre a superfície do metal. Essa camada protetora pode ser tornada mais espessa através de um processo denominado anodização (figura a seguir). Nesse processo, o oxigênio é gerado por eletrólise, segundo a semirreação
H2O(ℓ) → 12O2(g) + 2e– + 2H+(aq)
O oxigênio reage, em seguida, com o alumínio, formando o óxido correspondente.
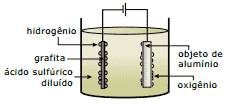
Com referência ao exposto, a afirmativa FALSA é:
A) A anodização aumenta a resistência do alumínio à corrosão.
B) O fluxo de elétrons, pelo circuito externo, ocorre na direção do objeto de alumínio.
C) O objeto de alumínio constitui o ânodo da célula eletroquímica.
D) O processo de anodização consome energia elétrica.
Questão 08. (PUC-SP) Pretende-se oxidar anodicamente 10,6 g de benzaldeído até ácido benzoico.
C6H5CHO + H2O → C6H5COOH + 2H+ + 2e–
Uma determinada corrente passa pela célula durante 5 horas, 21 minutos e 40 segundos. A corrente necessária para efetuar a transformação é igual a:
A) 0,5 ampére.
B) 1,0 ampére.
C) 2,0 ampéres.
D) 5,0 ampéres.
E) 1,5 ampére.
Questão 09. (UNESP–2010) A pilha esquematizada, de resistência desprezível, foi construída usando-se, como eletrodos, uma lâmina de cobre mergulhada em solução aquosa, contendo íons Cu2+ (1 mol.L–1), e uma lâmina de zinco mergulhada em solução aquosa, contendo íons Zn2+ (1 mol.L–1). Além da pilha, cuja diferença de potencial é igual a 1,1 Volts, o circuito é constituído de uma lâmpada pequena e uma chave interruptora (Ch). Com a chave fechada, o eletrodo de cobre teve um incremento de massa de 63,5 μg após 193 s.
Dados: P = U . i
Carga de um mol de elétrons = 96 500 C
Massas molares (g.mol–1): Zn = 65,4; Cu = 63,5
Cu2+(aq) + 2e– → Cu(s)
Zn2+(aq) + 2e– → Zn(s)
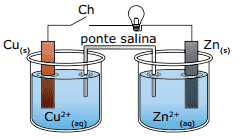
Considerando-se que a corrente elétrica se manteve constante nesse intervalo de tempo, a potência dissipada pela lâmpada nesse período foi de:
A) 1,1 mW.
B) 1,1 W.
C) 0,55 mW.
D) 96 500 W.
E) 0,22 mW.
Questão 10 sobre Lei de Faraday e Eletrólise: (UNIFESP–2008) A figura representa uma célula de eletrólise de soluções aquosas com eletrodo inerte. Também são fornecidos os potenciais padrão de redução (Eº) de algumas espécies.
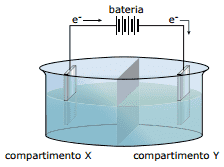
Na+(aq) + e– → Na(s) Eº = –2,71 V
2H+(aq) + 2e– → H2(g) Eº = 0,00 V
H2O(ℓ) + 12O2 + 2e– → 2OH–(aq) Eº = +0,40 V
Cℓ2(g) + 2e– → 2Cℓ–(aq) Eº = +1,32 V
Para essa célula, foram feitas as seguintes afirmações:
I. O polo positivo é o eletrodo do compartimento Y.
II. O ânodo é o eletrodo do compartimento X.
III. A d.d.p. para a eletrólise de uma solução aquosa de NaCℓ(aq) é positiva.
IV. Na eletrólise de solução aquosa de NaCℓ(aq), há formação de gás hidrogênio no eletrodo do compartimento Y.
V. Na eletrólise da solução aquosa de NaCℓ(aq), há formação de gás cloro no compartimento X.
São CORRETAS somente as afirmações:
A) I, II, III e IV
B) I, III e V
C) I, IV e V
D) II, III e IV
E) II, IV e V
🔵 >>> Confira a lista completa com todos os exercícios de Química.
Gabarito com as respostas do simulado com exercícios de física sobre Lei de Faraday e Eletrólise:
01. D;
02. A;
03. C;
04. E;
05. D;
06. C;
07. B;
08. B;
09. A;
10. E
Doutorando em Genética e Biologia Molecular – UESC-BA
Mestre em Genética e Biologia Molecular – UESC-BA
Pós-Graduado em Metodologia do Ensino de Biologia e Química – FAEL
Licenciado em Ciências Biologias – IFMT/Campus Juína
