Questão 01 com Exercícios sobre Ligações Covalentes: (UFU-MG) O fosfogênio (COCl2), um gás, é preparado industrialmente por meio da reação entre o monóxido de carbono e o cloro. A fórmula estrutural da molécula do fosfogênio apresenta:
A) uma ligação dupla e duas ligações simples.
B) uma ligação dupla e três ligações simples.
C) duas ligações duplas e duas ligações simples.
D) uma ligação tripla e duas ligações simples.
E) duas ligações duplas e uma ligação simples.
Questão 02. (UFPE–2008) Considerando os elementos químicos com as seguintes configurações eletrônicas:
Aa: 1s1;
Bb:1s2 2s1;
Cc: 1s2 2s2 2p2; Dd:1s2 2s2 2p4; Ee: 1s2 2s2 2p5;
Ff: 1s2 2s2 2p6; Gg:1s2 2s2 2p6 3s1;
Analise as afirmativas a seguir.
( ) Apenas dois desses elementos apresentam configuração eletrônica de gás nobre.
( )Aa e Dd podem formar moléculas diatômicas homonucleares.
( ) A molécula de Aa2 é formada por uma ligação simples, e a molécula de Dd2 tem ligação dupla.
( ) Aa, Bb e Ff pertencem ao mesmo grupo da Tabela Periódica.
( ) Bb, Cc e Ee pertencem ao mesmo período da Tabela Periódica.
Questão 03 com Exercícios sobre Ligações Covalentes: (UEPG-PR) Sobre os compostos a seguir, assinale o que for CORRETO.
I. Dióxido de carbono II. Cloreto de potássio III. Sulfeto de sódio IV. Oxigênio molecular
Dados:C(Z=6);O(Z=8);Na(Z=11);S(Z=16); Cl(Z=17); K(Z=19).
01. Em solução aquosa, o composto III sofre dissociação, formando apenas íons monovalentes.
02. Os compostos II e III apresentam ligação do tipo iônica.
04. Os compostos I e IV apresentam ligações por meio de atração eletrostática.
08. O composto I apresenta ligação do tipo covalente polar.
16. O composto IV apresenta ligação do tipo covalente apolar.
Soma ( )
Questão 04. (UFLA-MG–2009) Ligações químicas envolvendo átomos de carbono são características de moléculas orgânicas. O carbono forma ligações fortes com uma variedade de elementos, especialmente com H, O, N e halogênios. O comprimento de uma ligação química está relacionado à natureza dos átomos envolvidos e à ordem de ligação.
Das ligações a seguir, indique a ordem decrescente de comprimento de ligação.
A) C—H > C—C > C—O
B) C—C > C=C > C ≡≡C
C) C≡≡C > C=C > C—H
D) C=O > C—O > C—C
Questão 05 com Exercícios sobre Ligações Covalentes: (Enem) Linus Pauling foi o primeiro a elaborar o conceito de eletronegatividade. Em sua definição, eletronegatividade é a capacidade de um elemento atrair elétrons para si quando ele faz parte de um composto.
Ele argumentou que o excesso de energia ∆ de uma ligação A–B em relação à energia média das ligações A–A e B–B pode ser atribuída à presença de uma contribuição iônica à ligação covalente, devido à diferença de eletronegatividade entre os ligantes.
Disponível em:<http://www2.ufpa.br/quimdist/disciplinas/quimica_inorganica_teorica/cap114_estrutura.pdf.> (Adaptação). Acesso em: 12 fev. 2011.
A espécie química H–X apresenta um maior caráter iônico (43%) do que a espécie química H–Y (5%), portanto:
A) a ligação H–Y é mais polar do que a ligação H–X e por esse motivo, apresenta maior valor de ∆.
B) em uma amostra de um mol de H–X, num determinado instante, existem mais espécies iônicas do que em uma amostra de um mol de H–Y.
C) o momento de dipolo elétrico em uma espécie H–X é menos intenso do que em uma espécie H–Y.
D) o elevado caráter iônico da ligação H–X torna a densidade da nuvem eletrônica H–X mais uniforme do que a da espécie H–Y.
E) ambas as espécies apresentam coincidência dos centros de carga positiva e negativa.
Questão 06. (UFMG) Este gráfico representa a curva de energia potencial versus separação internuclear para a interação entre dois átomos de hidrogênio que formam a molécula H2.
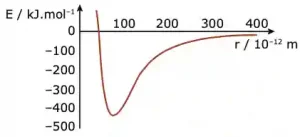
De acordo com o gráfico, todas as afirmativas estão corretas, EXCETO
A) A energia de ligação da molécula é cerca de 440 kJ.mol-1.
B) A energia do sistema é mínima quando a distância entre os átomos é cerca de 75×10-12 m.
C) A interação entre os átomos tende para zero quando a separação entre eles tende para o infinito.
D) A molécula é mais estável quando a distância entre os átomos é cerca de 75×10-12 m.
E) A molécula se forma quando os átomos absorvem cerca de 440 kJ.mol-1.
Questão 07 com Exercícios sobre Ligações Covalentes: (UFU-MG) Considere os seguintes átomos:
Em relação a esses átomos, marque a alternativa INCORRETA.
A) B é um átomo mais eletronegativo que A.
B) O raio atômico do átomo A é maior que o do átomo B.
C) A e B podem formar o composto sólido AB2, de baixo ponto de fusão.
D) B encontra-se nas condições ambiente (25 oC e 1 atm), como composto molecular B2.
Questão 08. Modelo Enem. Um dos métodos de extermínio, em massa, em campos de concentração nazistas era a câmara de gás. As principais vítimas eram idosos, crianças e inaptos ao trabalho. Um dos gases utilizados para tal fim era o gás cianídrico, HCN, que tem cheiro de amêndoas amargas e que entre cinco a trinta segundos após a sua aspiração, 0,3 mg por litro de ar, produz inconsciência, levando à morte entre três a quatro minutos.
A toxidez do HCN deve-se à sua capacidade de inibir a enzima citocromoxidase, fundamental para as células consumirem o gás oxigênio (O2) transportado pelo sangue. O íon cianeto (CN−) provoca a parada da respiração celular.
Das espécies químicas citadas no texto,
A) todas são iônicas.
B) duas são covalentes e uma iônica.
C) todas apresentam átomos que estabelecem ligações covalentes coordenadas.
D) todas apresentam átomos que se estabilizam pelo compartilhamento de um elétron.
E) todas apresentam ligações múltiplas.
Questão 09. (UFMG) A curva a seguir mostra a variação da energia potencial Ep em função da distância entre os átomos, durante a formação da molécula H2 a partir de dois átomos de hidrogênio, inicialmente a uma distância infinita um do outro.
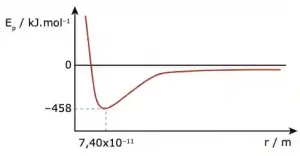
Em relação às informações obtidas da análise do gráfico, assinale a afirmativa FALSA.
A) A energia potencial diminui na formação da ligação química.
B) A quebra da ligação H—H consome 458 kJ.mol–1.
C) O comprimento de ligação da molécula H2 é de 7,40×10–11 m.
D) Os átomos separados por uma distância infinita se atraem mutuamente.
Questão 10 com Exercícios sobre Ligações Covalentes: (Fuvest-SP) Considere o elemento cloro formando compostos com, respectivamente, hidrogênio, carbono, sódio e cálcio.
a) Com quais desses elementos o cloro forma compostos covalentes?
b) Qual a fórmula eletrônica de um dos compostos covalentes formados?
🔵 >>> Confira nossa lista com todos os exercícios de química.
Gabarito com as respostas dos melhores exercícios de Química sobre Exercícios sobre Ligações Covalentes:
01. A;
02. F, V, V, F, V;
03. Soma = 26;
04. B;
05. B;
06. E;
07. C;
08. E;
09. D;
10. A) 
O cloro forma compostos “covalentes” com hidrogênio (H) e carbono (C), pois a ligação covalente se faz entre ametal ligado a ametal ou hidrogênio.
B) 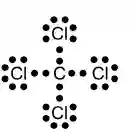
Doutorando em Genética e Biologia Molecular – UESC-BA
Mestre em Genética e Biologia Molecular – UESC-BA
Pós-Graduado em Metodologia do Ensino de Biologia e Química – FAEL
Licenciado em Ciências Biologias – IFMT/Campus Juína
