Questão 01 sobre Propriedades Coligativas: (Elite) Calcular o grau de dissociação iônica do NaCl em uma solução aquosa cuja concentração é de 80g/1 000g de H2O e que ferve a 101,35ºC. (Dados: Ke = 0,51ºC/molal; Na = 23u; Cl = 35,5u).
Questão 02. (Elite) Quando 1,645g de fósforo branco são dissolvidas em 60mL de sulfeto de carbono, cuja densidade é de 1,263g/mL, a solução ferve a 46,71ºC, enquanto o sulfeto de carbono puro ferve a 46,30ºC. Determinar a fórmula molecular do fósforo (dados: constante ebuliométrica do sulfeto de carbono = 2,34ºC/molal; massa atômica do fósforo = 31u).
Questão 03. (ITA) Duas soluções, A e B, têm as seguintes composições:
• solução A: 17,8g de antraceno (massa molecular = 178) em 100mL de benzeno;
• solução B: 6,4g de naftalina (massa molecular = 128) em 100mL de benzeno.
A relação das pressões de vapor PA e PB é:
a) pA = pB.
b) pA > pB.
c) pA < pB.
d) faltam dados para responder.
Questão 04 sobre Propriedades Coligativas: (Elite) Calcular a pressão de vapor e o abaixamento relativo de uma solução que possui 100g de açúcar (C12H22O11) em 500g de água, a 40ºC (dados: pressão de vapor da água a 40ºC = 55,3mmHg ou 55,3torr; massa molar do açúcar = 342g/mol; constante tonométrica da
água = 0,018 molal-1 ).
Questão 05. (Elite) Foram dissolvidas 0,2g de um composto em 74,6g de benzeno. A pressão de vapor da solução, a 20ºC, é de 73,6mmHg; a do benzeno puro é de 74,6mmHg. Determinar a massa molecular do composto, sabendo que a constante tonométrica do benzeno vale 0,078g/mol.
Questão 06. (Vunesp) A variação das pressões de vapor do CHCl3 e do C2H5Cl com a temperatura é mostrada no gráfico.
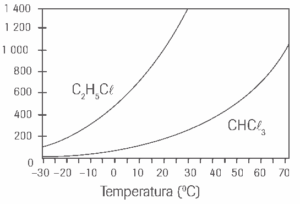
Considerando a pressão de 1 atmosfera:
a) A que temperatura cada substância entrará em ebulição?
b) Qual é o efeito da adição de um soluto não-volátil sobre a pressão de vapor das substâncias.
Questão 07 sobre Propriedades Coligativas: (PUC-SP) Uma certa massa de um dado soluto que se dissolve em 100g de benzeno determina um abaixamento de 1,28ºC no ponto de congelamento. A mesma massa do mesmo soluto, quando se dissolve em 100g de água, faz decrescer o ponto do congelamento em 1,395ºC. As constantes criométricas do benzeno e da água valem, respectivamente 5,12 e 1,86ºC/molal.
Se o soluto em questão não se dissocia quando dissolvido em benzeno e está totalmente dissociado em íons quando dissolvidos em água, pode-se afirmar que o número de íons em que se dissocia o soluto é igual a:
a) 6
b) 5
c) 3
d) 4
e) 2
Questão 08. (UFPA) Uma solução é preparada pela dissolução de 1g de etilenoglicol, C2H6O2, em 200g de água. Sabendo-se que a constante criométrica da água é 1,86ºC e a temperatura de congelamento da água é 0ºC, então a temperatura de congelamento da solução é:
(Dado: massa molar do C2H6O2 = 62g.mol-1)
a) –0,15ºC
b) –0,6ºC
c) 0,15ºC
d) 0,4ºC
e) –0,4ºC
Questão 09. (UFMG) Num congelador, há cinco formas que contêm líquidos diferentes para fazer gelo e picolés de limão. Se as formas forem colocadas, ao mesmo tempo, no congelador e estiverem, inicialmente, com a mesma temperatura, vai congelar-se primeiro a forma que contém 500mL de:
a) água pura.
b) solução, em água, contendo 50mL de suco de limão.
c) solução, em água, contendo 100mL de suco de limão.
d) solução, em água, contendo 50mL de suco de limão a 50g de açúcar.
e) solução, em água, contendo 100mL de suco de limão e 50g de açúcar.
Questão 10 sobre Propriedades Coligativas: (UERJ) Quando ganhamos flores, se quisermos que elas durem mais tempo, devemos mergulhá-las dentro da água e cortarmos, em seguida, a ponta da sua haste. Esse procedimento é feito com o objetivo de garantir a continuidade da condução da seiva bruta. Tal fenômeno ocorre graças à diferença de osmolaridade entre a planta e o meio onde ela está, que são, respectivamente:
a) hipotônica e isotônico.
b) isotônica e hipotônico.
c) hipertônica e isotônico.
d) hipotônica e hipertônico.
e) hipertônica e hipotônico.
🔵 >>> Confira a lista completa com todos os exercícios de Química.
Gabarito com as respostas dos exercícios sobre Propriedades Coligativas:
01. 93%;
02. A fórmula molecular é P4(atomicidade 4).
03. C;
04. Abaixamento Relativo: A = 0,01.
Pressão de vapor da solução: p = 54,7mmHg.
05. M1 = 15, 6u;
06. a) Cl2H5C : 13ºC.
b) CHCl3 : 60ºC.
c) A adição de um soluto não-volátil diminui a pressão de vapor do solvente.
07. C;
08. A;
09. A;
10. E
Doutorando em Genética e Biologia Molecular – UESC-BA
Mestre em Genética e Biologia Molecular – UESC-BA
Pós-Graduado em Metodologia do Ensino de Biologia e Química – FAEL
Licenciado em Ciências Biologias – IFMT/Campus Juína
