Questão 01 com Atividades sobre Reações Químicas: (Básico) Classifique as reações abaixo.

Questão 02. (Básico) Faça o balanceamento das equações químicas abaixo.

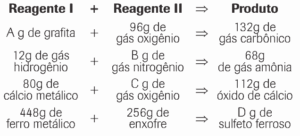
Questão 03. (Básico) Na tabela abaixo estão descritas algumas reações de síntese (sem excesso de substâncias). Com base na Lei de Lavoisier indique o valor da massa que substituiria corretamente as letras A, B, C e D nestas reações.
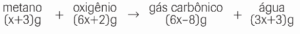
Questão 04 com Atividades sobre Reações Químicas: (Básico) Determine a massa de água que se forma no processo:
Questão 05. (Unicamp) Leia a frase seguinte e transforme-a em uma equação química (balanceada), utilizando símbolos e fórmulas: “uma molécula de nitrogênio gasoso, contendo dois átomos de nitrogênio por molécula, reage com três moléculas de hidrogênio diatômico, gasoso, produzindo duas moléculas de amônia gasosa, a qual é formada por três átomos de hidrogênio e um de nitrogênio”.

Questão 06. (Unificado) De acordo com a Lei de Lavoisier, quando fizermos reagir completamente, em ambiente fechado, 1,12g de ferro com 0,64g de enxofre, a massa, em g, de sulfeto de ferro obtida será de:
a) 2,76.
b) 2,24.
c) 1,76.
d) 1,28.
e) 0,48.
Questão 07 com Atividades sobre Reações Químicas: (PUC) O óxido de alumínio (Al2O3) é utilizado como antiácido. A reação que ocorre no estômago é:

Os coeficientes x, y, z e w são, respectivamente:
a) 1, 2, 3, 6.
b) 1, 6, 2, 3.
c) 2, 3, 1, 6.
d) 2, 4, 4, 3.
e) 4, 2, 1, 6.
Questão 08. (PUC) Pelo fato de o gás carbônico não ser combustível nem comburente, e ser mais denso que o ar, ele é usado em extintores de incêndio. Uma reação para a obtenção do gás carbônico pode ser representada pela equação:

Se essa equação for corretamente balanceada, a soma de todos os coeficientes mínimos e inteiros é igual a:
a) 5.
b) 8.
c) 12.
d) 14.
e) 20.
Questão 09. (Unirio) Observe a seguinte equação não-balanceada:
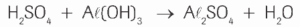
A soma dos coeficientes estequiométricos dessa reação é igual a:
a) 6.
b) 10.
c) 12.
d) 13.
e) 15.
Questão 10 com Atividades sobre Reações Químicas: (Unicamp) 22,4g de pregos são deixados expostos ao ar. Supondo que os pregos sejam constituídos unicamente por átomos de ferro e, que após algumas semanas a massa dos mesmos pregos tenha aumentado para 32g, pergunta-se:
a) Que fenômeno ocorreu com os pregos?
b) Que massa de oxigênio foi envolvido no processo?
c) Em que Lei das Combinações Químicas você se baseou para responder o item anterior?
🔵 >>> Confira a lista completa com todos os exercícios de Química.
Gabarito com as respostas das Atividades sobre Reações Químicas:
01.
a) Síntese.
b) Simples troca.
c) Decomposição.
d) Síntese.
e) Decomposição.
f) Simples troca.
g) Dupla troca.
h) Dupla troca.
i) Simples troca.
j) Dupla troca.
02.
a) 1, 12, 8.
b) 1, 5, 2.
c) 2, 11/2, 1, 4.
d) 2, 3, 1, 3.
e) 1, 3, 1, 3.
f) 2, 1, 1, 2.
g) 3, 2, 1, 6.
h) 2, 3, 1, 6.
i) 2, 11, 8, 8.
j) 3, 4, 1, 12.
03. A = 36g; B = 56g; C = 32g e D = 704g
04. 18g.
05. 1 N2(g) + 3 H2(g) → 2 NH3(g).
06. C;
07. B;
08. B;
09. C;
10.
a) Ferrugem ou oxidação do ferro.
b) 32 – 22,4 = 9,6g.
c) Lei da Conservação das Massas ou Lei de Lavoisier
Doutorando em Genética e Biologia Molecular – UESC-BA
Mestre em Genética e Biologia Molecular – UESC-BA
Pós-Graduado em Metodologia do Ensino de Biologia e Química – FAEL
Licenciado em Ciências Biologias – IFMT/Campus Juína
