Questão 01 sobre Reações Químicas e Teoria Atômica Clássica: (UFTM-MG) Indique, para as leis ponderais, a alternativa INCORRETA.
A) As massas de um elemento químico, que se combinam com uma massa fixa de um segundo elemento para formar compostos diferentes, estão entre si numa proporção de números inteiros, em geral pequenos.
B) Diferentes amostras de uma mesma substância contêm proporções idênticas dos elementos que a constituem.
C) Quando as massas de dois elementos, que reagem com a mesma massa de um terceiro elemento, reagirem entre si, elas o farão na mesma proporção das massas anteriores (ou múltiplos ou submúltiplos simples dessa relação).
D) Quando dois elementos se unem para formar um composto, a razão entre as massas que se combinam é sempre uma razão de números inteiros e pequenos.
E) A massa total de um sistema fechado não varia, qualquer que seja a reação química que aí se verifique.
Questão 02. (PUC-SP) Querendo verificar a Lei de Conservação das Massas (Lei de Lavoisier), um estudante realizou a experiência esquematizada a seguir:
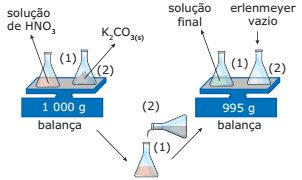
Terminada a reação, o estudante verificou que a massa final era menor que a massa inicial. Assinale a alternativa que explica o ocorrido.
A) A Lei de Lavoisier só é válida nas condições normais de temperatura e de pressão.
B) A Lei de Lavoisier não é válida para reações em solução aquosa.
C) De acordo com a Lei de Lavoisier, a massa dos produtos é igual à massa dos reagentes, quando estes se encontram no mesmo estado físico.
D) Para que se verifique a Lei de Lavoisier, é necessário que o sistema seja fechado, o que não ocorreu na experiência realizada.
Questão 03. (UFU-MG) Podemos considerar que Dalton foi o primeiro cientista a formalizar, do ponto de vista quantitativo, a existência dos átomos. Com base na evolução teórica e considerando os postulados de Dalton citados a seguir, marque a única alternativa considerada CORRETA nos dias atuais.
A) Os átomos de um elemento são todos idênticos.
B) Uma substância elementar pode ser subdividida até se conseguirem partículas indivisíveis chamadas átomos.
C) Dois ou mais átomos podem combinar-se de diferentes maneiras para formar mais de um tipo de composto.
D) É impossível criar ou destruir um átomo de um elemento químico.
Questão 04. (Unimontes-MG–2007) A busca da simplicidade dentro da complexidade da natureza levou John Dalton a propor o seu modelo de átomo, tendo como base as razões das massas dos elementos que se combinaram para formar compostos. A hipótese atômica que contraria o modelo proposto por Dalton é:
A) Uma transformação resulta em novos átomos.
B) Os átomos de um mesmo elemento são idênticos.
C) Átomos diferentes apresentam massas diferentes.
D) Um composto resulta da combinação de átomos.
Questão 05. (UERJ-2006) Na natureza nada se cria, nada se perde. Tudo se transforma. Esse enunciado é conhecido como Lei da Conservação das Massas ou Lei de Lavoisier. Na época em que foi formulado, sua validade foi contestada, já que na queima de diferentes substâncias era possível observar aumento ou diminuição de massa. Para exemplificar esse fenômeno, considere as duas balanças idênticas, I e II, mostradas na figura a seguir.
Nos pratos dessas balanças, foram colocadas massas idênticas de carvão e de esponja de aço, assim distribuídas:
• Pratos A e B: carvão
• Pratos C e D: esponja de aço
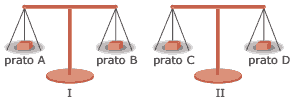
A seguir, nas mesmas condições reacionais, foram queimados os materiais contidos em B e C, o que provocou desequilíbrio nos pratos das balanças. Para restabelecer o equilíbrio, serão necessários procedimentos de adição e de retirada de massas, respectivamente, nos seguintes pratos:
A) A e D;
B) B e C;
C) C e A;
D) D e B
Questão 06. (UNESP) Em uma viagem, um carro consome 10 kg de gasolina. Na combustão completa desse combustível, na condição de temperatura do motor, formam-se apenas compostos gasosos. Considerando-se o total de compostos formados, pode-se afirmar que os mesmos:
A) não têm massa.
B) pesam exatamente 10 kg.
C) pesam mais que 10 kg.
D) pesam menos que 10 kg.
E) são constituídos por massas iguais de água e por gás carbônico.
Questão 07. (UFMG) Considere as seguintes reações químicas, que ocorrem em recipientes abertos, colocados sobre uma balança:
I. Reação de bicarbonato de sódio com vinagre, em um copo.
II. Queima de álcool, em um vidro de relógio.
III. Enferrujamento de um prego de ferro, colocado sobre um vidro de relógio.
IV. Dissolução de um comprimido efervescente, em um copo com água.
Em todos os exemplos, durante a reação química, a balança indicará uma diminuição da massa contida no recipiente, EXCETO em:
A) II.
B) I.
C) IV.
D) III.
Questão 08. (UFF-RJ–2009) Desde a Antiguidade, diversos povos obtiveram metais, vidro, tecidos, bebidas alcoólicas, sabões, perfumes, ligas metálicas; descobriram elementos e sintetizaram substâncias que passaram a ser usadas como medicamentos. No século XVIII, a Química, a exemplo da Física, torna-se uma ciência exata.
Lavoisier iniciou na Química o método científico, estudando os porquês e as causas dos fenômenos. Assim, descobriu que as transformações químicas e físicas ocorrem com a conservação da matéria. Outras leis químicas também foram propostas e, entre elas, as ponderais, ainda válidas.
Com base nas leis ponderais, pode-se afirmar que, segundo:
I. a Lei da Conservação das Massas (Lavoisier), 1,0 g de ferro, ao ser oxidado pelo oxigênio, produz 1,0 g de óxido férrico;
II. a Lei da Conservação das Massas, ao se usar 16,0 g de oxigênio molecular para reagir completamente com 40,0 g de cálcio, são produzidas 56 g de óxido de cálcio;
III. a Lei das Proporções Definidas, se 1,0 g de ferro reage com 0,29 g de oxigênio para formar o composto óxido ferroso, 2,0 g de ferro reagirão com 0,87 g de oxigênio, produzindo o mesmo composto;
IV. a Lei das Proporções Múltiplas, dois mols de ferro reagem com dois mols de oxigênio para formar óxido ferroso; logo, dois mols de ferro reagirão com três mols de oxigênio para formar óxido férrico.
Assinale a alternativa CORRETA:
A) As afirmativas I e II estão corretas.
B) A afirmativa II está correta.
C) As afirmativas II e III estão corretas.
D) As afirmativas II e IV estão corretas.
E) A afirmativa III está correta.
Questão 09. Modelo Enem. Os modelos atômicos são especialmente importantes para o entendimento de vários fenômenos e propriedades da matéria. A Teoria Atômica proposta por Dalton no início do século XIX ainda é útil para explicar determinadas transformações e leis atualmente aceitas. Assinale a alternativa que NÃO condiz com a Teoria Atômica de Dalton.
A) Lei das proporções constantes das massas de substâncias participantes de uma reação química.
B) Comportamento dos gases ideais.
C) Corrosão de metais.
D) Teoria das colisões moleculares utilizada para explicar a velocidade de reações químicas entre reagentes gasosos.
Questão 10. (PUC Minas–2007) Assinale a afirmativa que descreve ADEQUADAMENTE a Teoria Atômica de Dalton. Toda matéria é constituída de átomos:
A) os quais são formados por partículas positivas e negativas.
B) os quais são formados por um núcleo positivo e por elétrons que gravitam livremente em torno desse núcleo.
C) os quais são formados por um núcleo positivo e por elétrons que gravitam em diferentes camadas eletrônicas.
D) e todos os átomos de um mesmo elemento são idênticos.
Selecionamos mais algumas listas de exercícios sobre Química para lhe ajudar com seus estudos:
- Simulado sobre Radioatividade e Reações Nucleares;
- Simulado sobre o que São polímeros;
- Exercícios sobre Conceito de Equilíbrio Químico;
- Exercícios sobre os Impactos Ambientais no Solo e na Água.
🔵 >>> Confira a lista completa com todos os exercícios de Química.
Gabarito com as respostas da lista de exercícios de Química sobre Reações Químicas e Teoria Atômica Clássica:
Resposta da Questão 01. D;
Resposta da Questão 02. D;
Resposta da Questão 03. C;
Resposta da Questão 04. A ;
Resposta da Questão 05. B;
Resposta da Questão 06. C;
Resposta da Questão 07. D;
Resposta da Questão 08. D;
Resposta da Questão 09. C;
Resposta da Questão 10. D;
Doutorando em Genética e Biologia Molecular – UESC-BA
Mestre em Genética e Biologia Molecular – UESC-BA
Pós-Graduado em Metodologia do Ensino de Biologia e Química – FAEL
Licenciado em Ciências Biologias – IFMT/Campus Juína
