Questões 01 sobre Coeficiente de Solubilidade: (Vunesp/2002) A poluição térmica, provocada pela utilização de água de rio ou mar para refrigeração de usinas termoelétricas ou nucleares, vem do fato de a água retornar ao ambiente em temperatura mais elevada que a inicial. Este aumento de temperatura provoca alteração do meio ambiente, podendo ocasionar modificações nos ciclos de vida e de reprodução e, até mesmo, a morte de peixes e plantas.
O parâmetro físico-químico alterado pela poluição térmica, responsável pelo dano ao meio ambiente, é:
a) a queda da salinidade da água.
b) a diminuição da solubilidade do oxigênio na água.
c) o aumento da pressão de vapor da água.
d) o aumento da acidez da água, devido à maior dissolução de dióxido de carbono na água.
e) o aumento do equilíbrio iônico da água.
Questões 02. (Unifesp/2002) Uma solução contendo 14 g de cloreto de sódio dissolvidos em 200 mL de água foi deixada em um frasco aberto, a 30°C. Após algum tempo, começou a cristalizar o soluto. Qual volume mínimo e aproximado, em mL, de água que deve ter evaporado quando se iniciou a cristalização? (Solubilidade, a 30°C, do cloreto de sódio = 35 g / 100 g de água; densidade da água a 30°C = 1,0 g/mL):
a) 20.
b) 40.
c) 80.
d) 100.
e) 160.
Questões 03. (UFMG/06) Sabe-se que o cloreto de sódio pode ser obtido a partir da evaporação da água do mar. Analise este quadro, em que está apresentada a concentração de quatro sais em uma amostra de água do mar e a respectiva solubilidade em água a 25°C.
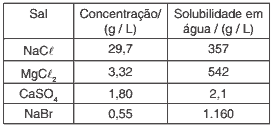
Considerando-se as informações desse quadro, é CORRETO afirmar que, na evaporação dessa amostra de água do mar a 25°C, o primeiro sal a ser precipitado é o
a) NaBr.
b) CaSO4.
c) NaCl.
d) MgCl2.
Questões 04 sobre Coeficiente de Solubilidade: (Unifesp/05) As solubilidades dos sais KNO3 e NaCl, expressas em gramas do sal por 100 gramas de água, em função da temperatura, estão representadas no gráfico a seguir.
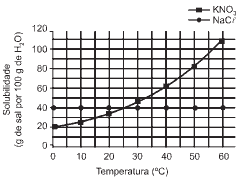
Com base nas informações fornecidas, pode-se afirmar, corretamente, que:
a) a dissolução dos dois sais em água são processos exotérmicos.
b) quando se adicionam 50 g de KNO3 em 100 g de água a 25°C, todo o sólido se dissolve.
c) a solubilidade do KNO3 é maior que a do NaCl para toda a faixa de temperatura abrangida pelo gráfico.
d) quando se dissolvem 90 g de KNO3 em 100 g de água em ebulição, e em seguida se resfria a solução a 20°C, recupera-se cerca de 30 g do sal sólido.
e) a partir de uma amostra contendo 95 g de KNO3 e 5 g de NaCl, pode-se obter KNO3 puro por cristalização fracionada.
Questões 05. (Ufmg/2008) Numa aula no Laboratório de Química, os alunos prepararam, sob supervisão do professor, duas soluções aquosas, uma de cloreto de potássio, KCl, e uma de cloreto de cálcio, CaCl2. Após observarem a variação da temperatura em função do tempo, durante o preparo de cada uma dessas soluções, os alunos elaboraram este gráfico:
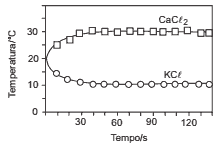
Considerando-se as informações fornecidas por esse gráfico e outros conhecimentos sobre o assunto, é CORRETO afirmar que:
a) a dissolução do CaCl2 diminui a energia cinética média das moléculas de água.
b) a dissolução do KCl é um processo exotérmico.
c) a entalpia de dissolução do CaCl2 é maior que zero.
d) a solubilidade do KCl aumenta com o aumento da temperatura.
Questões 06. (PUC-Rio/2008) Observe o gráfico a seguir.
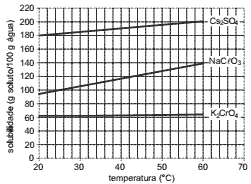
A quantidade de clorato de sódio capaz de atingir a saturação em 500 g de água na temperatura de 60°C, em grama, é APROXIMADAMENTE igual a:
a) 70.
b) 140.
c) 210.
d) 480.
e) 700.
TEXTO PARA AS PRÓXIMAS 2 QUESTÕES:
Questões 07 sobre Coeficiente de Solubilidade: (Fgv/2010) Uma solução aquosa de dicromato de potássio, quando resfriada a 40°C, formou 240 g de sal cristalizado. Se essa mesma solução fosse resfriada a 10°C, teria formado 340 g de sal cristalizado.
Considerando-se que a cristalização é completa nas temperaturas examinadas, pode-se afirmar que a massa dessa solução de dicromato de potássio é igual a:
a) 1000 g.
b) 950 g.
c) 890 g.
d) 800 g.
e) 315 g.
O gráfico mostra a curva de solubilidade do sal dicromato de potássio em água.
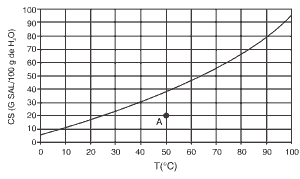
Questões 08. (Fgv/2010) A solução indicada pelo ponto A e o tipo de dissolução do dicromato de potássio são denominadas, respectivamente:
a) insaturada e endotérmica.
b) insaturada e exotérmica.
c) saturada e endotérmica.
d) supersaturada e endotérmica.
e) supersaturada e exotérmica.
Questões 09. (Acafe/2012) Um técnico preparou 420 g de uma solução saturada de nitrato de potássio KNO3 dissolvida em água em um béquer a uma temperatura de 60°C. Depois deixou a solução esfriar até uma temperatura de 40°C, verificando a presença de um precipitado.
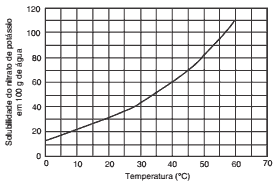
A massa aproximada desse precipitado é:
(desconsidere a massa de água presente no precipitado)
a) 100 g.
b) 60 g.
c) 50 g.
d) 320 g.
Questões 10 sobre Coeficiente de Solubilidade: (Ufg/2012) Uma solução saturada de K2Cr2O7 foi preparada com a dissolução do sal em 1,0 kg de água. A influência da temperatura sobre a solubilidade está representada na figura a seguir.
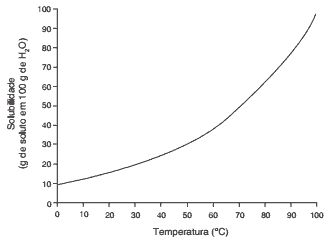
Com base nos dados apresentados, as massas dos dois íons resultantes da dissociação do K2Cr2O7 a 50°C serão aproximadamente, iguais a:
Dado: Densidade da água: 1,0 g/mL
a) 40 e 105 g
b) 40 e 260 g
c) 80 e 105 g
d) 80 e 220 g
e) 105 e 195 g
🔵 >>> Confira a lista completa com todos os exercícios de Química.
Gabarito com as respostas do simulado de química sobre Coeficiente de Solubilidade:
01. b;
02. e;
03. b;
04. e;
05. d;
06. e;
07. a;
08. c;
09. a;
10. d
Doutorando em Genética e Biologia Molecular – UESC-BA
Mestre em Genética e Biologia Molecular – UESC-BA
Pós-Graduado em Metodologia do Ensino de Biologia e Química – FAEL
Licenciado em Ciências Biologias – IFMT/Campus Juína
