Questão 01 sobre Misturas Gasosas: (Unicamp SP/2002) Observando o local do incêndio, nossos heróis perceberam que aquele não era o lugar ideal para guardar nem medicamentos, nem reagentes destinados ao laboratório de análises da empresa. Apesar disso, o local era considerado o mais seguro e, como também era refrigerado, fora o escolhido. Destruição geral! Como a explosão fora seguida de incêndio e de outras explosões, o teto e as janelas foram destruídos, e a chuva, apesar de ajudar a extinguir o fogo, também causou estragos. Examinando com cuidado o local, Rango observou várias garrafas e garrafões quebrados além de uma estante metálica caída e uma geladeira destruída… Preso aos cacos de um garrafão de 5 litros, pôde ler num rótulo: “Éter etílico”. O volume do almoxarifado foi estimado em 82 metros cúbicos.
— E se o éter de 5 garrafões, contendo 4 kg de éter, cada um, houvesse se evaporado naquela sala?…
— perguntou–se Rango.
a) Considerando o conteúdo de cinco garrafões, qual a pressão parcial aproximada do éter (C4H10O) que evaporou no almoxarifado, supondo que ele tivesse se distribuído uniformemente e considerando as propriedades de gás ideal? Constante universal dos gases = 0,082 atm L K-1 mol-1 . Temperatura = 27°C.
b) Se apenas 10% do vapor de éter tivesse se queimado, qual a energia liberada em joules?
Dado: DH = –2530 kJ mol-1 (combustão do éter).
Questão 02. (Fatec SP/2001) Uma mistura de metano (CH4) e cloro (Cl2), ambos gasosos, em proporções estequiométricas, foi submetida à ação da luz, como ilustrado a seguir:
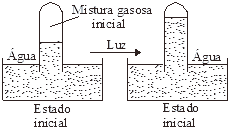
A equação: CH4(g) + Cl2(g) ® CH3Cl(g) + HCl(g) representa a reação que ocorreu. Considerando rendimento de 100%, afirma-se que a diferença observada entre os volumes gasosos nos estados inicial e final deve-se:
I. à quantidade de mols de gás produzido, que aumentou a pressão interna;
II. à dissolução do HCl gasoso na água, que causou redução da pressão interna;
III. à água que, ao ser “empurrada” para dentro do tubo, comprimiu a mistura gasosa.
Dessas afirmações, apenas
a) a I está correta.
b) a II está correta.
c) a III está correta.
d) a I e aII estão corretas.
e) a II e aIII estão corretas.
Questão 03 sobre Misturas Gasosas: (Fuvest SP/1995/1ªFase) A oxidação da amônia (NH3) com oxigênio, a alta temperatura e na presença de catalisador, é completa, produzindo óxido nítrico (NO) e vapor d’água. Partindo de amônia e oxigênio, em proporção estequiométrica, qual a porcentagem (em volume) de NO na mistura gasosa final?
a) 10%
b) 20%
c) 30%
d) 40%
e) 50%
Questão 04. (Unifesp SP/2003/1ªFase) Um recipiente de 10 L, contendo 2,0 mol de H2 e 1,0 mol de Cl2, é aquecido e mantido a 105ºC. A pressão no interior do recipiente, antes da reação, nestas condições, é 9,3 atm.
Após alguns dias, o H2 (g) e o Cl2 (g) reagem completamente formando HCl (g).
Após reação total, a quantidade total de gases no recipiente e a pressão parcial do HCl no interior do recipiente, à temperatura de 105ºC, devem ser, respectivamente,
a) 1,0 mol e 3,1 atm.
b) 2,0 mol e 6,2 atm.
c) 3,0 mol e 6,2 atm.
d) 3,0 mol e 9,3 atm.
e) 5,0 mol e 6,2 atm.
Questão 05. (ITA SP/1996) Considere um recipiente de paredes reforçadas (volume fixo) provido de torneira, manômetro e de um dispositivo para produção de faíscas análogo à “vela de ignição” em motores de automóveis. No fundo do recipiente também é colocado um dissecante granulado (ex. sílica gel). Neste recipiente, previamente evacuado, se introduz uma mistura de hidrogênio gasoso até que a pressão dentro dele atinja o valor de 0,70 atm., a temperatura sendo mantida em 20ºC.
O problema é descobrir a proporção de H2 e N2 nesta mistura inicial. Para isso se junta excesso de O2 à mistura, já no recipiente, até que a pressão passe ao valor de 1,00 atm. Em seguida se faz saltar uma faisca através da mistura. Assim, a temperatura e a pressão sobem transitoriamente. Deixando a mistura voltar à temperatura de 20ºC, notamos que o manômetro acusa uma pressão de 0,85 atm. (Lembrar que a água formada é absorvida pelo dissecante, não exercendo pressão parcial significativa).
Das informações acima podemos concluir que a fração molar do hidrogênio na mistura inicial de H2 e N2 era igual a:
a) 0,07.
b) 0,11.
c) 0,14.
d) 0,70.
e) 1,00.
Questão 06 sobre Misturas Gasosas: (ITA SP/1994) Por ocasião do jogo Brasil versus Bolívia, disputado em La Paz, um comentarista esportivo afirmou que:
“Um dos maiores problemas que os jogadores da seleção brasileira de futebol terão que enfrentar, é o fato de o teor de oxigênio no ar, em La Paz, ser cerca de 40% menor do que aquele ao nível do mar.” Lembrando que a concentração do oxigênio no ar, ao nível do mar, é aproximadamente 20% (v / v) e supondo que no dia em que o comentarista fez esta afirmação a pressão atmosférica, em La Paz, fosse igual a, aproximadamente, 450 mmHg, qual das opções abaixo contém a afirmação que mais se aproxima daquilo que o comentarista poderia ter dito?
Em La Paz…
a) a concentração do oxigênio no ar é cerca de 12% ( v / v ).
b) a fração molar o oxigênio no ar é cerca de 0,12.
c) a pressão parcial do oxigênio no ar é aproximadamente expressa por (0,20 x 760 mmHg x 0,60).
d) a pressão parcial do oxigênio no ar é cerca de 152 mmHg.
e) a pressão parcial do oxigênio no ar é aproximadamente expressa por (0,20 x 760 mmHg x 0,40).
Questão 07. (ITA SP/1993) Dois balões de vidro, A e B, de mesmo volume contêm ar úmido. Em ambos os balões a pressão e a temperatura são as mesmas, a única diferença sendo que no balão A umidade relativa do ar é de 70% enquanto que no balão B ela é de apenas 10%. Em relação ao conteúdo destes dois balões é ERRADO afirmar que:
a) Os dois balões contêm o mesmo número de moléculas.
b) Os dois balões contêm a mesma quantidade de gás, expressa em mol.
c) No balão B há maior massa de nitrogênio.
d) No balão A há maior massa total de gás.
e) A quantidade (mol) e a massa (grama) de vapor de água são maiores no balão A.
Questão 08 sobre Misturas Gasosas: (ITA SP/1993) Quando dizemos que o ar tem 15% de umidade relativa, queremos dizer que neste ar:
a) 15% das moléculas são de água.
b) 15% da massa são de água.
c) A pressão parcial do vapor de água é 15% da pressão total.
d) A pressão parcial do vapor de água é 0,15 x 760 mmHg.
e) A pressão parcial do vapor de água é 15% da pressão de vapor saturante para a temperatura em que se encontra o ar.
Questão 09. (Unip SP/1991) Recolhe-se o gás hidrogênio produzido pela reação: Mg(s) + 2HCl(aq) -> MgCl2(aq) + H2(g) sobre água na aparelhagem representada no desenho.
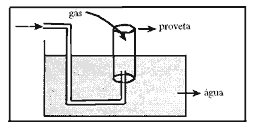
Sendo: Patmosférica= pressão atmosférica
PH2 = pressão parcial do hidrogênio
PH2O = pressão parcial da água gasosa
Quando os níveis da água dentro e fora da proveta forem iguais, pode. se afirmar que:
a) PH2 = Patmosférica + PH2O
b) PH2 = zero
c) PH2 = Patmosférica – PH2O
d) PH2 = PH2O
e) PH2 = Patmosférica
Questão 10 sobre Misturas Gasosas: (IME RJ) Num motor selado de 1,5L, sob vácuo, um certo volume de um composto orgânico, tóxico e volátil, de massa molar 99g/mol, foi aquecido até 600K. Nesta temperatura, metade da quantidade do composto original se decompôs, formando monóxido de carbono e cloro. Se a pressão final no recipiente foi de 32,8 atm, determine:
a) a fórmula estrutural plana do composto orgânico original;
b) o número inicial de moléculas do composto orgânico.
Dado R=0,082 atm .L/mol. K
C=12; )=16; Cl=35,5
Avogadro=6,0 . 1023
🔵 >>> Confira a lista completa com todos os exercícios de Química.
Gabarito com as respostas do simulado com 10 exercícios de química sobre Misturas Gasosas:
01.
a) P = 0,081 atm
b) y = 68.310 kJ
02. B;
03. D;
04. C;
05. A;
06. C;
07. D;
08. E;
09. B;
10.
a) COCl2
b) 4,0 . 1023 moléculas
Doutorando em Genética e Biologia Molecular – UESC-BA
Mestre em Genética e Biologia Molecular – UESC-BA
Pós-Graduado em Metodologia do Ensino de Biologia e Química – FAEL
Licenciado em Ciências Biologias – IFMT/Campus Juína
