Questão 01 sobre a Lei da Diluição de Ostwald: (UFMG) A tabela a seguir indica o pH aproximado de alguns sistemas, a 25 ºC.
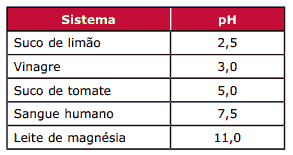
Considerando-se as informações dessa tabela, a afirmativa FALSA é:
A) A concentração de íons H3O+, no sangue humano, é inferior a 10–2 mol.L-1.
B) A concentração de íons H3O+, no vinagre, é 10-3 mol.L-1.
C) A concentração de íons OH–, no leite de magnésia, é 10-11 mol.L-1.
D) A concentração de íons OH–, no suco de tomate, é maior do que no vinagre.
E) Suco de limão é mais ácido do que vinagre.
Questão 02. (Unimontes-MG–2009) Preparou-se uma solução aquosa de um ácido com concentração 0,03 mol/L. O pH da solução foi medido, encontrando-se o valor 3,0. A análise desses dados revela que:
A) o grau de ionização do ácido é igual a 3,3%.
B) o soluto é considerado um ácido forte.
C) o ácido está completamente dissociado.
D) a concentração de prótons é 3,0×10-2 mol/L.
Questão 03 sobre a Lei da Diluição de Ostwald: (Fafeod-MG) Através das constantes de dissociação (sic) dos ácidos e das bases (em meio aquoso), pode-se estimar a força destes. Para as substâncias HNO2, NH2OH e HCN, temos as seguintes constantes:
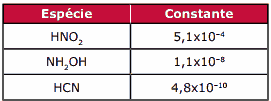
Em relação a essas espécies, é INCORRETO afirmar que:
A) o NO2– é uma base mais forte do que o CN–.
B) o HCN é ácido mais fraco do que o HNO2.
C) o NH3OH+ é ácido mais forte do que o HCN.
D) o NO2– é base mais fraca do que o NH2OH.
Questão 04. (Fatec-SP) O grau de ionização de um ácido em uma solução 0,1 mol.L-1, cuja constante de ionização é 9,0×10-7 a 25 ºC, vale, aproximadamente:
A) 0,3%.
B) 0,9%.
C) 3,0%.
D) 9,0%.
E) 30,0%.
Questão 05 sobre a Lei da Diluição de Ostwald: (UFMG) A tabela a seguir informa o pH aproximado de algumas soluções ácidas de concentração igual a 10-11 mol.L-1, a 25 ºC.
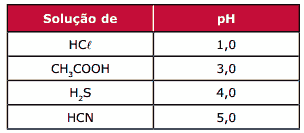
Com relação a essas soluções aquosas, a 25 ºC, a que apresenta MAIOR concentração de H+ é:
A) CH3COOH.
B) HCℓ.
C) HCN.
D) H2S.
Questão 06. (UFMG–2009) Considere certa quantidade de água e de suco de limão, misturados, contida em um copo. Analise estas três afirmativas concernentes a esse sistema:
I. O sistema é ácido.
II. O pH do sistema é maior que 7.
III. No sistema, a concentração dos íons H+ é maior que a dos íons OH–.
A partir dessa análise, é CORRETO afirmar que:
A) apenas as afirmativas I e II estão certas.
B) apenas as afirmativas I e III estão certas.
C) apenas as afirmativas II e III estão certas.
D) as três afirmativas estão certas.
Questão 07 sobre a Lei da Diluição de Ostwald: (UFOP-MG–2008) A figura a seguir apresenta uma escala relativa de pH de diversas misturas e soluções aquosas bastante comuns.
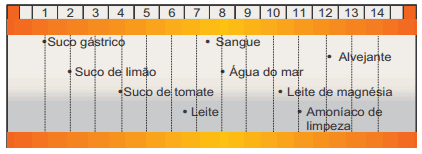
Tomando por base essa escala relativa e considerando a [H3O+] como critério de acidez, é CORRETO afirmar que:
A) o suco gástrico é cerca de três vezes mais ácido que o suco de tomate.
B) o suco de limão é cerca de 100 vezes mais ácido que o suco de tomate.
C) o sangue é cerca de quatro vezes mais básico que o leite de magnésia.
D) o alvejante é cerca de 100 vezes mais básico que o amoníaco de limpeza.
Questão 08. (FUVEST-SP–2010) As figuras a seguir representam, de maneira simplificada, as soluções aquosas de três ácidos, HA, HB e HC, de mesmas concentrações. As moléculas de água não estão representadas.
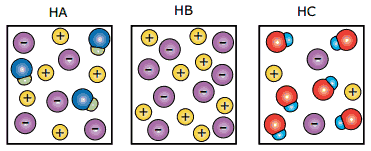
Considerando-se essas representações, foram feitas as seguintes afirmações sobre os ácidos:
I. HB é um ácido mais forte do que HA e HC.
II. Uma solução aquosa de HA deve apresentar maior condutibilidade elétrica do que uma solução aquosa de mesma concentração de HC.
III. Uma solução aquosa de HC deve apresentar pH maior do que uma solução aquosa de mesma concentração de HB.
Está CORRETO o que se afirma em:
A) I, apenas.
B) I e II, apenas.
C) II e III, apenas.
D) I e III, apenas.
E) I, II e III.
Questão 09. (UFMG–2010) A 10,0 mL de uma solução aquosa 0,100 mol/L de ácido clorídrico, HCℓ(aq), adicionou-se água pura, em quantidade suficiente para se obterem 100,0 mL de solução diluída.
Considerando-se essas informações, é CORRETO afirmar que o pH da solução resultante é:
A) 1.
B) 2.
C) 6.
D) 10.
Questão 10 sobre a Lei da Diluição de Ostwald: (FESP-PR) O vibrião colérico não sobrevive em meio de pH = 3, ou mais ácido. O número de gotas de uma solução 1,0 M de ácido clorídrico que se deve introduzir em 10 litros de água, a fim de eliminar o vibrião colérico é Dado: Admita que não há alteração de volume e que o volume de uma gota é 0,05 mL:
A) 10 gotas.
B) 100 gotas.
C) 30 gotas.
D) 200 gotas.
E) 50 gotas.
🔵 >>> Confira a lista completa com todos os exercícios de Química.
Gabarito com as respostas do simulado com exercícios de Química sobre Lei da Diluição de Ostwald:
01. C;
02. A;
03. A;
04. A;
05. B;
06. B;
07. B;
08. E;
09. B;
10. D
Doutorando em Genética e Biologia Molecular – UESC-BA
Mestre em Genética e Biologia Molecular – UESC-BA
Pós-Graduado em Metodologia do Ensino de Biologia e Química – FAEL
Licenciado em Ciências Biologias – IFMT/Campus Juína
