Questão 01 sobre Equilíbrio Químico: (Elite) Escreva a expressão da constante de equilíbrio em termos de concentração (Kc) dos seguintes equilíbrios:
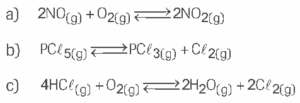
Questão 02. (Cesgranrio) O gráfico seguinte refere-se ao sistema químico ![]() ao qual se aplica o Princípio de Le Châtelier.
ao qual se aplica o Princípio de Le Châtelier.
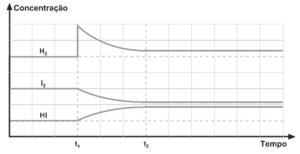
Analise o gráfico e indique a opção correta:
a) A adição de I2(g) em t1 aumentou a concentração de HI(g).
b) A adição de H2(g) em t2 aumentou a concentração de I2(g).
c) A adição de H2(g) em t2 levou o sistema ao equilíbrio.
d) A adição de H2(g) em t1 aumentou a concentração de HI(g).
e) A adição de HI(g) em t2 alterou o equilíbrio do sistema.
Questão 03. Modelo Enem. A seguir são apresentados a equação química da síntese da amônia na indústria, a relação da constante de equilíbrio (Kc) e os seus valores determinados experimentalmente. Analise esses dados.

Julgue os itens a seguir, colocando V para verdadeiro e F para falso.
a) Na reação em questão, os reagentes não são totalmente transformados em amônia.
b) No estado de equilíbrio, em um sistema fechado, estão presentes a amônia (NH3) ou os gases hidrogênio (H2) e nitrogênio (N2).
c) Analisando os valores de Kc da tabela, conclui-se que o rendimento da reação na indústria será maior na temperatura de 25ºC do que na temperatura de 1 000ºC.
d) A uma mesma temperatura, o aumento na concentração dos gases hidrogênio (H2) e nitrogênio (N2) alterará a concentração da amônia (NH3) no novo estado de equilíbrio sem alterar o valor de Kc.
Questão 04 sobre Equilíbrio Químico: (UFRJ) O gráfico ao lado representa alterações na concentração das espécies N2, H2 e NH3, que estão em equilíbrio no instante t0, sob pressão e temperatura constantes. Analise o gráfico e responda:
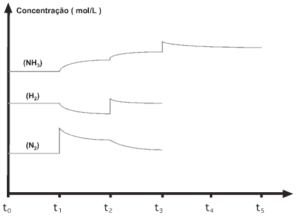
a) Que substância foi adicionada ao sistema em t1?
b) Que variação sofre a constante de equilíbrio (Kc) quando variam as concentrações em t2?
c) Como variam as concentrações de N2 e H2 em t3?
d) Como variam as concentrações de NH3 e de H2 em t4, quando N2 é retirado?
Questão 05. Modelo Enem. Considere as seguintes afirmações sobre equilíbrios químicos:
I. As velocidades das reações opostas são iguais.
II. No equilíbrio não existem reações químicas.
III. As concentrações dos participantes são iguais entre si.
IV. As concentrações dos participantes são constantes ao longo do tempo.
Estão corretas somente as afirmativas:
a) I e II.
b) I e III.
c) I e IV.
d) II e III.
e) III e IV.
Questão 06. Modelo Enem. A expressão de equilíbrio do processo ![]() pode ser dada por:
pode ser dada por:
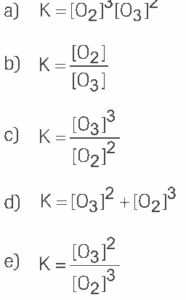
Questão 07 sobre Equilíbrio Químico: Modelo Enem. No processo reversível ![]() admita que a constante de equilíbrio seja igual a 4, em uma dada temperatura. Sabendo que a concentração de N2O4 vale 0,5 mol/L, a concentração de NO2 valerá:
admita que a constante de equilíbrio seja igual a 4, em uma dada temperatura. Sabendo que a concentração de N2O4 vale 0,5 mol/L, a concentração de NO2 valerá:
a) Raiz quadrada de 2 mol/L
b) 2 mol/L
c) 2,5 mol/L
d) 3 mol/L
e) 3,5 mol/L
Questão 08. Escreva a expressão da constante de equilíbrio (Kc) para as seguintes reações genéricas de equilíbrios homogêneos:
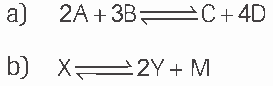
Questão 09. Considere o processo ![]() No equilíbrio, uma análise revela:
No equilíbrio, uma análise revela:
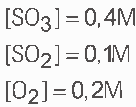
Determine o valor da constante de equilíbrio (Kc) na temperatura do processo.
Questão 10 sobre Equilíbrio Químico: Um equilíbrio homogêneo possui, a 25ºC, uma constante Kc = 10. A equação química é dada por![]() . No equilíbrio tem-se:
. No equilíbrio tem-se:
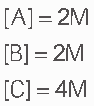
Determine [D].
🔵 >>> Confira a lista completa com todos os exercícios de Química.
Gabarito com as respostas da lista de questões sobre Equilíbrio Químico:
01. 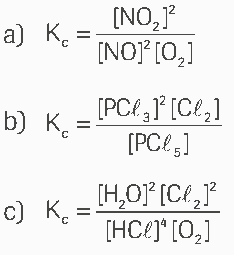
02. D;
03. a) V
b) F
c) V
d) V
04. Considerando que, quando ocorre a adição de qualquer participante do equilíbrio, há um aumento brusco em sua concentração (↑) nesse instante e que sua concentração diminui gradativamente até atingir uma nova situação de equilíbrio, demonstrada graficamente por uma reta paralela à abscissa.
a) No instante t1 ocorreu um aumento brusco na concentração do N2.
b) A variação de concentração não altera a constante de equilíbrio (Kc).
c) No instante t3 ocorreu um aumento brusco na concentração de NH3, o que provocou um deslocamento do equilíbrio para a esquerda: N 3H 2NH 2 + 2 ![]() 3 fazendo com que as concentrações de N2 e H2 aumentassem.
3 fazendo com que as concentrações de N2 e H2 aumentassem.
d) Se o N2 for retirado no instante t4, o equilíbrio se desloca para a esquerda e, com isso, a concentração NH3 diminui e a de H2 aumenta.
05. C;
06. E;
07. A;
08.
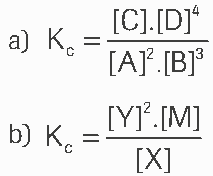
09.
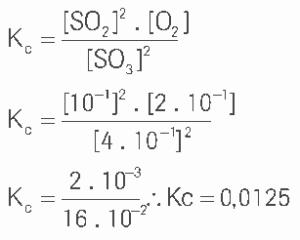
10.
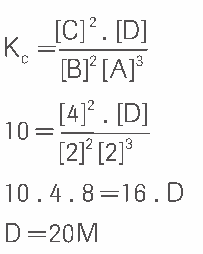
Doutorando em Genética e Biologia Molecular – UESC-BA
Mestre em Genética e Biologia Molecular – UESC-BA
Pós-Graduado em Metodologia do Ensino de Biologia e Química – FAEL
Licenciado em Ciências Biologias – IFMT/Campus Juína
