Questão 01 sobre Densidade e Difusão: (Ufc CE/2001/1ªFase). Ao desejar identificar o conteúdo de um cilindro contendo um gás monoatômico puro, um estudante de Química coletou uma amostra desse gás e determinou sua densidade, d = 5,38 g/L, nas seguintes condições de temperatura e pressão:
15oC e 0,97 atm. Com base nestas informações, e assumindo o modelo do gás ideal:
Dados: R = 0,082 atmL mol-1 K-1
a) calcular a massa molar do gás
b) Identificar o gás
Questão 02. (ITA SP/2000) Considere as afirmações abaixo relativas ao aquecimento de um mol de gás N2 contido em um cilindro provido de um pistão móvel sem atrito:
I. A massa específica do gás permanece constante.
II. A energia cinética média das moléculas aumenta.
III. A massa do gás permanece a mesma.
IV. O produto pressão x volume permanece constante.
Das afirmações feitas, estão CORRETAS
a) apenas I , II e III
b) apenas I , e IV
c) apenas II e III
d) apenas II , III e IV
e) todas
Questão 03 sobre Densidade e Difusão: (Fuvest SP/2001/1ªFase). Deseja-se preparar e recolher os gases metano, amônia e cloro. As figuras I, II e III mostram dispositivos de recolhimento de gases em tubos de ensaio.
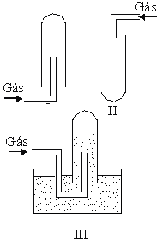
Considerando os dados da tabela abaixo:
massa molar solubilidade em
g/mol água
metano 16 desprezível
amônia 17 alta
cloro 71 alta
ar 29 baixa
escolha, dentre os dispositivos apresentados, os mais adequados para recolher, nas condições ambientes, metano, amônia e cloro. Esses dispositivos são, respectivamente,
a) II, II e III.
b) III, I e II
c) II, III e I.
d) II, I e III.
e) III, III e I.
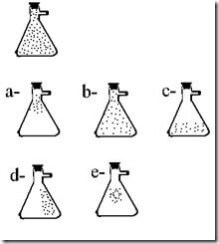
Questão 04. (Umg MG/1989) O frasco representado abaixo contém gás hidrogênio puro. Parte do hidrogênio é retirado, ligando-se o tubo lateral do frasco a uma bomba de vácuo.
A alternativa que mostra o conteúdo do frasco após o desligamento da bomba é:
Questão 05 sobre Densidade e Difusão: (ITA SP/1997). Três recipientes fechados, providos de êmbolos móveis, contêm a mesma quantidade (mol) do único gás especificado: N2 no recipiente 1 ; CO no recipiente 2 e CO2 no recipiente 3. Considerando a temperatura medida em Kelvin e a pressão em atm., são feitas as afirmações:
I. Se a pressão e a temperatura forem as mesmas, as massas específicas dos gases nos recipientes 1 e 2 serão praticamente iguais.
II. Se a pressão e a temperatura forem as mesmas, as massas específicas dos gases nos recipientes 2 e 3 serão praticamente iguais.
III. Se a temperatura for a mesma, mas a pressão no interior do recipiente 1 for o duplo da pressão no recipiente 2, a massa específica do gás no recipiente 1 será praticamente o duplo da massa específica do gás no recipiente 2.
IV. Se a temperatura for a mesma, mas a pressão no interior do recipiente 3 for o duplo da pressão no recipiente 2, a massa específica do gás no recipiente 3 será maior do que o duplo da massa específica do gás no recipiente 2.
V. Se a pressão for a mesma, mas a temperatura do recipiente 1 for o duplo da temperatura no recipiente 2, a massa específica do gás no recipiente 1 será praticamente o duplo da massa específica do gás no recipiente 2.
Estão CORRETAS apenas:
a) I, III e IV.
b) I e II.
c) I e V.
d) II e V.
e) III e IV.
Questão 06. (Uftm MG/2001/1ªFase). Durante um experimento de laboratório, foi queimada uma amostra de 0,7054 g de um composto orgânico numa corrente de ar. Terminada a queima foram encontrados 1125 mL de dióxido de carbono a 50°C, 700 mmHg e 0,7047 g de água. Admitindo que esse composto contenha apenas C, H e O, pergunta-se.
a) Qual é a fórmula mínima do composto?
b) Qual é a fórmula centesimal do composto?
c) Verificou-se que a densidade do vapor do composto a 150°C e 1,5 atm era, aproximadamente, 2,6 vezes maior que a do nitrogênio nas mesmas condições de temperatura e pressão. Qual é a fórmula molecular do hidrocarboneto?
d) Qual é a sua massa molecular correta?
Dados: R = 62,4 l.mmHg .K-1.mol-1; AN = 14,0; AC = 12,01 ; AH = 1,0; AO = 16,0; TO = 273 K.
Questão 07 sobre Densidade e Difusão: (Unicamp SP) Um balão meteorológico de cor escura, no instante de seu lançamento, contém 100 mols de gás Hélio (He). Após ascender a uma altitude de 15km, a pressão de gás se reduziu a 100 mmHg e a temperatura, devido à irradiação solar, aumentou para 77oC. Calcule, nessas condições:
a) o volume do balão meteorológico.
b) a densidade do Hélio em seu interior.
Dados: R=62 mm Hg L/mol.K
Questão 08. (Unicamp SP/1993). Quando o magnésio metálico entra em contato com o ácido clorídrico (HCl) ocorre uma reação com liberação de um gás A. o mesmo ácido reage com carbonato de magnésio (MgCO3) produzindo outro gás B. uma bexiga cheia com o gás A, quando solta no ar, sobe; e outra, cheia com o gás B, desce. Observação: o termo bexiga, conforme usado nesta questão, equivale a balão ou bola de aniversário em outras regiões do país.
a) escreva as reações representativas dessas reações.
b) explique o comportamento das bexigas.
Questão 09. (FCChagas BA/1992) Metano começa a escapar por um pequeno orifício com a velocidade de 36 mililitros por minuto. Se o mesmo recipiente, nas mesmas condições , contivesse brometo de hidrogênio, qual seria a velocidade inicial de escape, pelo mesmo orifício?
Dados: H=1; C=12; Br=80.
a) (4 . 36)/9 mililitros por minuto
b) (16 . 36)/81 mililitros por minuto
c) 9 / (36 . 4) mililitros por minuto
d) 81/(16 . 36) mililitros por minuto
e) (4 . 6)/9 mililitros por minuto
Questão 10 sobre Densidade e Difusão: (Puc SP/1994). Um gás tem densidade 0,50g/L a 27oC. se sua temperatura passar a 327oC, à pressão constante, qual o valor de sua densidade?
a) 6g/L
b) 1g/L
c) 0,50g/L
d) 0,25g/L
e) 0,04g/L
🔵 >>> Confira a lista completa com todos os exercícios de Química.
Gabarito com as respostas do simulado com exercícios sobre Gases Perfeitos Densidade e Difusão:
01.
a) 131,05g/mol
b) Xenônio
02. C
I- Falso, pela equação de Clapeyron e admitindo os dados, temos:
Logo a massa específica depende da temperatura e como houve aquecimento haverá variação.
II- Verdadeiro. A energia cinética diretamente proporcional à temperatura logo haverá aumento.
III- Verdadeiro. Admitindo que não há saída de massa do cilindro, ela será constante independentemente do tempo.
IV- Falso. Pela equação de Clapeyron, temos:
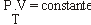
O produto P . V é diretamente proporcional à temperatura, logo, haverá aumento desse produto.
03. B
O único gás que pode ser recolhido sob água é o metano (III) por ser praticamente insolúvel. A amônia tem densidade inferior à do ar, logo pode ser recolhida na aparelhagem esquematizada em (I). Já o cloro, devido a sua alta densidade, pode ser recolhido diretamente num tubo de ensaio, como mostrado em (II).
04. B;
05. A;
RESOLUÇÃO
Fórmula para cálculo de massa específica:
d = P . mol
R . T
II- Falso. Como os gases têm a mesma massa molar e T e P são mantidos constantes, ambos apresentam a mesma massa específica.
V- Falso. A massa específica é inversamente proporcional a temperatura absoluta (reduz à metade).
06. a) A fórmula mínima é C4H8O.
b) Cálculo das porcentagens em massa:
C = 66,6%; H = 11,2%; ) = 22,2%
c) Cálculo da massa molar do composto a partir dos dados experimentais (Mexp.):
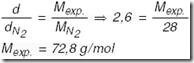
Considerando-se que a pequena discrepância na massa molar experimental e a massa molar calculada a partir da fórmula mínima e das massas atômicas fornecidas (72,12 g/mol) é devida a erros experimentais, concluímos que a fórmula molecular é igual à fórmula mínima:C4H8O .
d) A massa molecular correta é calculada da seguinte maneira:
C4H8O: 4.12,01 + 8.1,01 + 1.16,0 = 72,12 u
Comentário: o composto orgânico citado não é um hidrocarboneto porque é constituído de átomos de oxigênio, além de hidrogênio e carbono. ]
07. a) 2,17 . 104L
b) 1,84 . 10-2g/L
08. a) Mg + 2HCl ®MgCl2 + H2(g)
MgCO3 + 2HCl ®MgCl2 + H2O + CO2(g)
b) a bexiga cheia com o gás A (H2) sobe, pois esse gás é menos denso que o ar; a bexiga B com o CO2 desce, pois esse gás é mais denso que o ar.
09. A
10. D
Doutorando em Genética e Biologia Molecular – UESC-BA
Mestre em Genética e Biologia Molecular – UESC-BA
Pós-Graduado em Metodologia do Ensino de Biologia e Química – FAEL
Licenciado em Ciências Biologias – IFMT/Campus Juína
