Questão 01 sobre Conceito Ácido Base: (Ufc CE/2008/1ªFase). A força dos ácidos e bases depende de uma série de propriedades das substâncias. Assim, a força de um ácido de BrØnsted do tipo H2E é inversamente proporcional à força da ligação H–E. Com relação às espécies H2O, H2S e H2Se, é correto afirmar que:
a) a ligação H–O é mais fraca do que a ligação H–S, que é mais fraca do que a ligação H–Se.
b) o íon HS– é uma base mais forte do que o HSe– devido à maior densidade de carga.
c) as espécies H2O, H2Se e H2S não são consideradas ácidos de BrØnsted.
d) o íon HS– é um melhor receptor de próton do que o íon HO–.
e) a ordem crescente de acidez é H2O, H2Se e H2S.
Questão 02. (Ufg GO/2008/2ªFase) A histidina, um aminoácido, é utilizada pelo organismo para síntese da histamina, por meio de uma reação de descarboxilação.
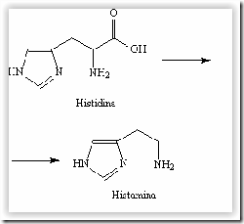
a) Explique qual das duas substâncias é mais solúvel.
b) Explique, de acordo com a teoria de Bronsted-Lowry, por que a histidina apresenta caráter anfótero em meio aquoso, enquanto seu derivado, a histamina, não.
Questão 03. (Uem PR/2007/Janeiro). Considerando as reações
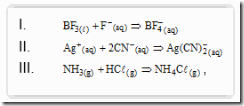
é correto afirmar que
a) o NH3(g) é uma base segundo Arrhenius.
b) o Ag+ é ácido segundo Lewis.
c) o CN− é um ácido segundo Brönsted-Lowry.
d) o BF3 é uma base segundo Lewis.
e) o HCl é uma base segundo Brönsted-Lowry.
Questão 04 sobre Conceito Ácido Base: (Unifor CE/2007/Janeiro) Analise as equações:
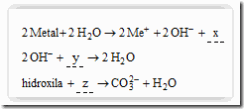
Completam-se corretamente as equações substituindo-se x, y e z, respectivamente, por:
a) H2, 2H+ e OH–
d) H2, 2H+ e CO2
e) 2H+, H2 e OH–
Questão 05. (Uepg PR/2007/Janeiro). Abaixo estão mostrados uma série de ácidos com as suas respectivas equações de ionização e constantes de equilíbrio:
I. HF (aq) + H2O (l) ![]() H3O+(aq) + F–(aq) Ka = 7,2 x10–4.
H3O+(aq) + F–(aq) Ka = 7,2 x10–4.
II. HPO![]() (aq) + H2O(l)
(aq) + H2O(l) ![]() H3O+(aq) + PO
H3O+(aq) + PO![]() (aq) Ka = 3,6 x10–13.
(aq) Ka = 3,6 x10–13.
III. CH3CO2H (aq) + H2O(l) ![]() H3O+(aq) + CH3CO
H3O+(aq) + CH3CO![]() (aq) Ka = 1,8×10–5.
(aq) Ka = 1,8×10–5.
Sobre os ácidos acima, assinale o que for correto.
01. Se forem comparadas três soluções dos ácidos acima mostrados numa mesma concentração, a que apresentará o maior pH será a solução de HF.
02. O ácido mais forte é o HF.
04. O íon CH3CO![]() é a base conjugada do CH3CO2H.
é a base conjugada do CH3CO2H.
08. O ácido mais fraco é o HPO![]() .
.
16. Todos se comportam como ácidos de Bronsted-Lowry.
Questão 06. (Unifor CE/2007/Julho). Considerando-se a distribuição dos elétrons, as estruturas da molécula de água e da molécula de peróxido de hidrogênio são, respectivamente,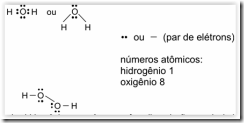
Peróxido de hidrogênio, em água, sofre dissociação produzindo cátions hidroxônio. Nesse caso, considerando-se a distribuição dos elétrons nas espécies envolvidas, pode-se escrever: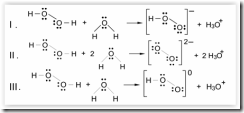
Está correto SOMENTE
a) I
b) II
c) III
d) I e II
e) II e III
Questão 07 sobre Conceito Ácido Base: (Uepg PR/2007/Julho) O dióxido de enxofre (SO2) é um dos responsáveis pela chuva ácida, principalmente em áreas densamente povoadas. Ele pode combinar-se com a água, de acordo com a seguinte reação: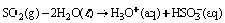
O SO2 também pode reagir com o oxigênio da atmosfera, formando o trióxido de enxofre, que reage com a água, de acordo com as reações descritas abaixo: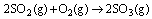
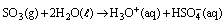
A respeito dessas reações e dos óxidos nelas envolvidos, assinale o que for correto.
01. O SO2 e o SO3 são conhecidos como anidridos ácidos.
02. Os ácidos formados a partir dos óxidos SO2 e SO3 são, respectivamente, o ácido sulfídrico (H2SO3) e o ácido sulfúrico (H2SO4).
04. Muitos óxidos de não metais, tais como o SO2 e o SO3, agem como bases de Lewis, já que os átomos de oxigênio puxam elétrons do átomo central, fazendo-os agir como um receptor de elétrons.
08. O ácido formado a partir do SO3 é um ácido mais forte que o ácido formado a partir do SO2.
Questão 08. (Uepg PR/2007/Julho). Com base nas informações contidas na tabela abaixo, que relaciona três ácidos comumente presentes em nosso cotidiano com seus respectivos valores de constante de ionização, assinale o que for correto.
01. Os três ácidos indicados são ácidos de Bronsted, e suas respectivas fórmulas químicas são: ![]() , H3PO4 e H2CO3.
, H3PO4 e H2CO3.
02. O ácido fosfórico é o mais forte porque ele apresenta mais hidrogênios na sua estrutura.
04. O ácido clorídrico, em solução aquosa, encontra-se dissociado nos seus respectivos íons.
08. A ordem crescente de acidez é a seguinte: ácido carbônico < ácido clorídrico < ácido fosfórico.
Questão 09. (Ufba BA/2007/2ªFase) A estocagem de CO2 emitido por usinas termelétricas, no subsolo, constitui um método que vem recebendo atenção crescente como uma das formas de diminuir o aquecimento da atmosfera da Terra. Pesquisadores acreditam que os melhores depósitos são de rochas sedimentares (arenito) repletas de poros preenchidos com salmoura (água salgada), onde a pressão é cerca de 100 vezes a pressão atmosférica. O CO2 pressurizado, injetado em fase “supercrítica”, substitui a salmoura nas formações geológicas.
A equação química ![]() representa o comportamento do CO2(l), a 100 atm, quando em equilíbrio químico com a salmoura.
representa o comportamento do CO2(l), a 100 atm, quando em equilíbrio químico com a salmoura.
Com base nessas informações e admitindo que o CO2(l) é solúvel na salmoura e que essa solução é constituída unicamente por NaCl(aq),
• identifique a base conjugada do íon H3O+(aq) de acordo com os conceitos sobre ácidos e bases de Brönsted-Lowry;
• verifique se ocorre variação de pH do sistema em equilíbrio com a injeção de mais CO2(l), a 100 atm, no depósito de rochas sedimentares e justifique sua resposta.
Questão 10 sobre Conceito Ácido Base: (Uni-Rio RJ/2007). Macroalgas verdes, como a Ulva fasciata, podem absorver íons cúprico, através de uma interação deste íon com os grupos oxigenados de açúcares presentes neste vegetal.
Em interações deste tipo, o íon cúprico atua como um:
a) ácido de Bonstëd.
b) ácido de Lewis.
c) ácido de Arrhenius.
d) base de Lewis.
e) base de Bonstëd.
🔵 >>> Confira a lista completa com todos os exercícios de Química.
Gabarito com as respostas dos exercícios de química sobre o Conceito Ácido Base:
01. B;
02. a) A histidina é mais solúvel em água, pois apresenta o grupo funcional carboxila, que é polar. Assim, sua polaridade é maior que a da histamina; além disso, em meio aquoso ocorre a formação do íon zwitterion, conseqüentemente, haverá maior interação com o solvente em questão, a água, que é polar.
b) A histidina pode reagir como ácido de Bronsted-Lowry (cedendo próton) ou como base de Bronsted-Lowry (recebendo próton), pois possui grupo carboxila e nitrogênios básicos, que podem doar ou aceitar prótons. Já a histamina só reagirá como base, pois possui nitrogênios que podem receber prótons, em meio aquoso.
03. B;
04. C;
05. 30;
06. D;
07. 09;
08. 01;
09. • De acordo com os conceitos sobre ácidos e bases de Brönsted-Lowry, a base conjugada do íon H3O+(aq) é a água.
• Não há variação de pH do sistema com a injeção de mais CO2(l) em razão do sistema em equilíbrio estar saturado, considerando-se que o dióxido de carbono e a água encontram-se na fase líquida.
10. B
Doutorando em Genética e Biologia Molecular – UESC-BA
Mestre em Genética e Biologia Molecular – UESC-BA
Pós-Graduado em Metodologia do Ensino de Biologia e Química – FAEL
Licenciado em Ciências Biologias – IFMT/Campus Juína
