Questão 01 sobre Equilíbrio iônico de ácidos e bases: Modelo Enem. Considerando os dados a seguir, assinale a alternativa CORRETA.
Ácido Ka
A. HF 7,0×10-4
B. C6H5COOH 7,0×10-5
C. NH4+ 6,0×10-10
A) Em soluções aquosas do ácido A, praticamente não existem moléculas de HF.
B) O ácido C é o mais forte.
C) Soluções aquosas de mesma concentração dos três ácidos apresentam condutividades elétricas diferentes.
D) O equilíbrio C6H5COOH + H2O C6H5COO− + H3O+ encontra-se deslocado para a direita.
E) No equilíbrio representado por NH4+ + H2O NH3 + H3O+ a concentração em mol/L de NH4+ é menor do que a de NH3.
Questão 02. (Fatec-SP) Analisando as constantes de ionização dos monoácidos a seguir, a uma dada temperatura, KHA = 2,5×10-2 ; KHB = 3,0×10-4 ; KHC = 5,0×10-6, podemos concluir que a ordem crescente do grau de ionização, para a mesma concentração em mol.L-1, é:
A) HA < HB < HC.
B) HA < HC < HB.
C) HC < HB < HA.
D) HC < HA < HB.
E) HB < HC < HA.
Questão 03 sobre Equilíbrio iônico de ácidos e bases: (FCMMG–2008) Considere uma solução 0,01 mol/L de H2SO4(aq).
Com relação ao pH dessa solução, a proposição CORRETA é;
A) pH = 1
B) pH = 2
C) pH = 0,01
D) 1 < pH < 2
Questão 04. (FCMMG–2008) A 10 mL de solução aquosa de NaOH, de concentração 0,10 mol/L, foram adicionados 10 mL de solução aquosa de HCℓ, cujo pH era igual a 2. Com relação às características da solução resultante, todas as proposições estão corretas, EXCETO:
A) [Na+] > [Cℓ–]
B) [Na+] = 0,1 mol/L
C) [H3O+] < 10-7 mol/L
D) [OH–] = 0,045 mol/L
Questão 05 sobre Equilíbrio iônico de ácidos e bases: (Cesgranrio) Entre os antiácidos caseiros, destacam-se o leite de magnésia e o bicarbonato de sódio. Quantas vezes o leite de magnésia (pH = 11) é mais básico do que uma solução de bicarbonato de sódio (pH = 8)?
A) 3
B) 19
C) 88
D) 100
E) 1 000
Questão 06. (UnB-DF / Adaptado) A reação de dissolução do ácido acético (HAc) em água pode ser representada pela equação HAc H+ + Ac – Considerando uma solução aquosa de ácido acético 0,100 mol.L-1, JULGUE os itens.
( ) As espécies presentes na solução são: H3O+, Ac–, HAc, OH–, e H2O.
( ) A concentração de H+ no equilíbrio, [H+], é 0,100 mol.L-1.
( ) [Ac–] > [HAc].
( ) O pOH da solução é 1.
( ) A constante de equilíbrio da reação anterior é igual à constante de dissociação do ácido acético.
( ) Na água pura, o pH é diferente do pOH.
( ) O pH não varia com a temperatura.
Questão 07 sobre Equilíbrio iônico de ácidos e bases: (UFMG) Considerando os valores das constantes de ionização dos ácidos HX, K x = 1,0×10-3; HY, Ky= 4,0×10-5 e HZ, Kz = 8,0×10-8, marque a proposição FALSA.
A) Em soluções de mesma concentração mol.L-1, a concentração hidrogeniônica, [H+], de HX é maior do que a de HY, e a deste, maior do que a de HZ.
B) A base conjugada X– é mais fraca que Y–, e esta é mais fraca que Z–.
C) pKx < pKy < pKz.
D) Diluindo-se as soluções de HX, HY e HZ, aumentam-se os valores de Kx, Ky e Kz.
E) Diluindo-se as soluções de HX, HY e HZ, aumentam-se os valores dos respectivos graus de ionização.
Questão 08. (UFJF-MG–2009) Alguns animais aquáticos apresentam limites de resistência em relação ao pH da água onde habitam. Por exemplo, a faixa de pH de sobrevivência de camarões é 5,5 – 5,8 e a dos caramujos é 7,0 – 7,5.
Considere as concentrações de H+ nas soluções A, B e C apresentadas na tabela a seguir:
Solução [H+] / mol.L-1
A = 1,0×10-7
B < 1,0×10-7
C > 1,0×10-7
Sobre a sobrevivência desses animais nessas soluções, é CORRETO afirmar que:
A) somente os camarões sobreviveriam na solução A.
B) os camarões sobreviveriam na solução B.
C) os caramujos sobreviveriam na solução C.
D) somente os caramujos sobreviveriam na solução A.
E) ambos os animais sobreviveriam em qualquer das três soluções, A, B ou C.
Questão 09. (PUC-Campinas-SP) Uma área agrícola foi adubada com amônia, nitrato e fosfato de amônio. Na amostra das águas residuais da irrigação dessa área, verifica-se que a concentração de íons OH–(aq) é igual a 8×10-5 mol.L-1, a 25 ºC. Pode-se afirmar que a amostra tem pH igual a:
Dados: log 8 = 0,90; Kw = [H+] . [OH–] = 1×10-14 a 25 ºC
A) 9,9.
B) 8,5.
C) 7,0.
D) 6,9.
E) 3,9.
Questão 10 sobre Equilíbrio iônico de ácidos e bases: (UFMG) Alguns valores do produto iônico da água estão no quadro.
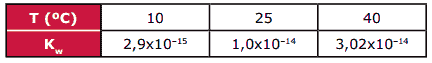
Considerando esses dados, todas as alternativas estão corretas, EXCETO
A) A concentração de íons H+ é igual à de íons OH–a qualquer temperatura.
B) A dissociação da água é um processo endotérmico.
C) A elevação da temperatura aumenta o pH da água pura.
D) O pH da água pura a 10 ºC é maior do que 7.
E) O pH da água pura a 25 ºC é igual a 7.
Questão 11. (Enem–1998) O pH informa a acidez ou a basicidade de uma solução. A escala a seguir apresenta a natureza e o pH de algumas soluções e da água pura, a 25 ºC.
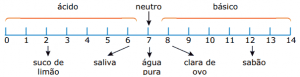
Uma solução desconhecida estava sendo testada no laboratório por um grupo de alunos. Esses alunos decidiram que deveriam medir o pH dessa solução como um dos parâmetros escolhidos na identificação da solução.
Os resultados obtidos estão na tabela a seguir:
Aluno Valor de pH
Carlos 4,5
Gustavo 5,5
Simone 5,0
Valéria 6,0
Paulo 4,5
Wagner 5,0
Renata 5,0
Rodrigo 5,5
Augusta 5,0
Eliane 5,5
Da solução testada pelos alunos, o professor retirou 100 mL e adicionou água até completar 200 mL de solução diluída. O próximo grupo de alunos a medir o pH deverá encontrar para o mesmo:
A) valores inferiores a 1,0.
B) os mesmos valores.
C) valores entre 5 e 7.
D) valores entre 5 e 3.
E) sempre o valor 7.
Questão 12 sobre Equilíbrio iônico de ácidos e bases: (Enem–1999) As informações a seguir foram extraídas do rótulo da água mineral de determinada fonte.
Água mineral natural
Composição química provável em mg/L
Sulfato de estrôncio ………………………………….. 0,04
Sulfato de cálcio ………………………………………. 2,29
Sulfato de potássio …………………………………… 2,16
Sulfato de sódio ………………………………………65,71
Carbonato de sódio …………………………………143,68
Bicarbonato de sódio ………………………………..42,20
Cloreto de sódio ………………………………………. 4,07
Fluoreto de sódio ……………………………………… 1,24
Vanádio ………………………………………………… 0,07
Características físico-químicas
pH a 25 ºC …………………………………………….. 10,00
Temperatura da água na fonte ……………………. 24 ºC
Condutividade elétrica ………………..4,40×10–4 ohms/cm
Resíduo de evaporação a 180 ºC …………. 288,00 mg/L
Classificação
Alcalino-bicarbonata, fluoretada, vanádica
Indicadores ácido-base são substâncias que em solução aquosa apresentam cores diferentes conforme o pH da solução. O quadro a seguir fornece as cores que alguns indicadores apresentam à temperatura de 25 ºC.
Indicador Cores conforme o pH
Azul de bromotimol amarelo em pH ≤ 6,0; azul em pH ≥ 7,6
Vermelho de metila vermelho em pH ≤ 4,8; amarelo em pH ≥ 6,0
Fenolftaleína incolor em pH ≤ 8,2; vermelho em pH ≥ 10,0
Alaranjado de metila vermelho em pH ≤ 3,2; amarelo em pH ≥ 4,4
🔵 >>> Confira a lista completa com todos os exercícios de Química.
Gabarito com as respostas do simulado com questões de Química sobre Equilíbrio iônico de ácidos e bases:
01. C;
02. C;
03. D;
04. B;
05. E;
06. V, F, F, F, V, F, F;
07. D;
08. D;
09. A;
10. C;
11. A;
12. C
Doutorando em Genética e Biologia Molecular – UESC-BA
Mestre em Genética e Biologia Molecular – UESC-BA
Pós-Graduado em Metodologia do Ensino de Biologia e Química – FAEL
Licenciado em Ciências Biologias – IFMT/Campus Juína
